AGUA 28 Generalidades El agua es el medio
































- Slides: 37

AGUA 28

Generalidades • • El agua es el medio liquido fundamental en el que se va a desarrollar la mayor parte de las reacciones químicas de la célula Es el principal disolvente biológico 29

Generalidades Sustancia mas abundante en los sistemas vivos, responsable del 70% o mas del peso de la mayoria de los organismos. Las fuerzas de atraccion entre las moleculas del agua y su ligera tendencia a ionizarse son de crucial importancia para la estructura y funcion de las biomoleculas. 30

Generalidades La molecula de agua y sus productos de ionizacion, H+ y OH-, influencian profundamente la estructura, ensamblaje y propiedades de todos los componentes celulares: proteinas, acidos nucleicos y � lipidos. � 31

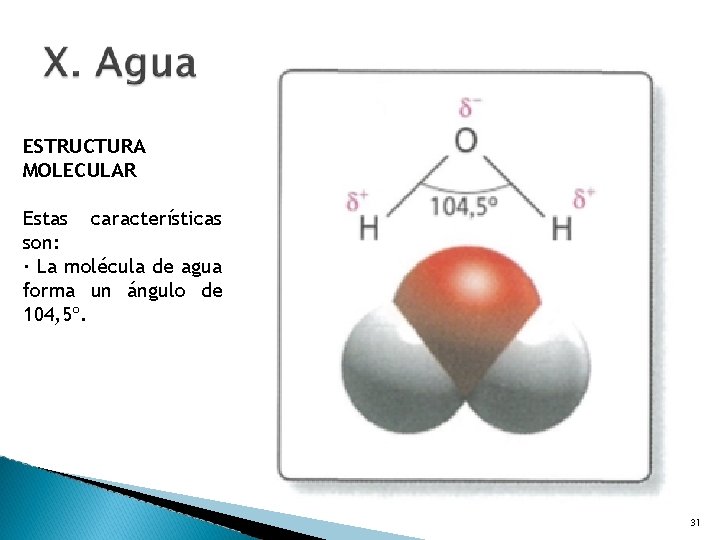
ESTRUCTURA MOLECULAR El agua es una molécula formada por dos átomos de Hidrógeno y uno de Oxígeno. La unión de esos elementos con diferente electronegatividad proporciona unas características poco frecuentes. HO 2 31

ESTRUCTURA MOLECULAR Características son: 1. La molécula de agua forma un ángulo de 104, 5º. 2. La molécula de agua es neutra. 3. La molécula de agua, aun siendo neutra, forma un dipolo, 31

ESTRUCTURA MOLECULAR Estas características son: · La molécula de agua forma un ángulo de 104, 5º. 31

PROPIEDADES DEL AGUA El agua tiene propiedades especiales, derivadas de su singular estructura. Estas propiedades son: 1. ELEVADO CALOR ESPECÍFICO 2. ELEVADO CALOR DE VAPORIZACIÓN 3. ELEVADA TENSIÓN SUPERFICIAL 4. ALTA CONSTANTE DIELÉCTRICA 5. BAJO GRADO DE IONIZACIÓN 6. LA DENSIDAD DEL AGUA 31

PROPIEDADES DEL AGUA ELEVADO CALOR ESPECÍFICO: para aumentar la temperatura del agua un grado centígrado es necesario comunicarle mucha energía para poder romper los puentes de Hidrógeno que se generan entre las moléculas. 31

PROPIEDADES DEL AGUA ELEVADO CALOR DE VAPORIZACIÓN: el agua absorbe mucha energía cuando pasa de estado líquido a gaseoso. 31

PROPIEDADES DEL AGUA ELEVADA TENSIÓN SUPERFICIAL: las moléculas de agua están muy cohesionadas por acción de los puentes de Hidrógeno. Esto produce una película de agua en la zona de contacto del agua con el aire. Como las moléculas de agua están tan juntas el agua es incompresible. 31

PROPIEDADES DEL AGUA CAPILARIDAD: el agua tiene capacidad de ascender por las paredes de un capilar debido a la elevada cohesión o adhesión molecular. ALTA CONSTANTE DIELÉCTRICA: la mayor parte de las moléculas de agua forman un dipolo, con un diferencial de carga negativo y un diferencial de carga positivo. 31

PROPIEDADES DEL AGUA BAJO GRADO DE IONIZACIÓN: la mayor parte de las moléculas de agua no están disociadas. Sólo un reducido número de moléculas sufre disociación, generando iones positivos (H+) e iones negativos (OH-). En el agua pura, a 25ºC, sólo una molécula de cada 10. 000 está disociada, por lo que la concentración de H+ es de 10 -7. Por esto, el p. H del agua pura es igual a 7. 31

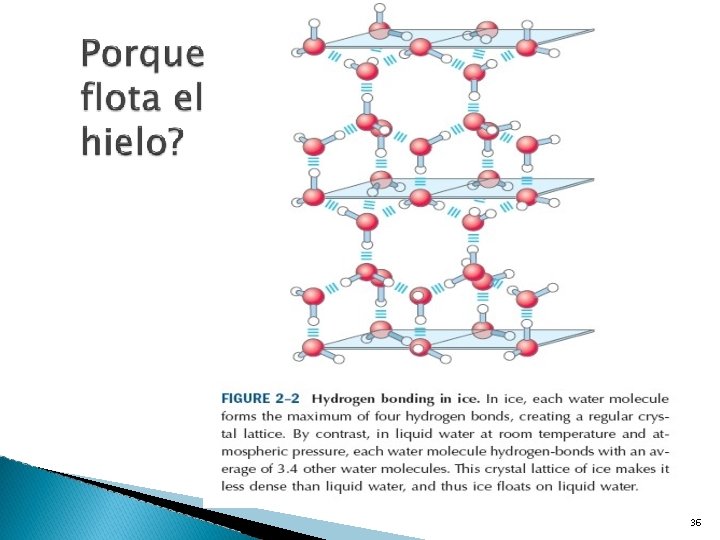
PROPIEDADES DEL AGUA LA DENSIDAD DEL AGUA: en estado líquido, el agua es más densa que en estado sólido. Por ello, el hielo flota en el agua. Esto es debido a que los puentes de Hidrógeno formados a temperaturas bajo cero unen a las moléculas de agua ocupando mayor volumen. 31

36

� Los puentes de hidrogeno formados entre las moleculas de agua, proveen las fuerzas cohesivas que dan la propiedad de ser liquida a temperatura ambiente y favorecen el ordenamiento extremo de las moleculas, tipico del agua en estado cristalino (hielo). 32

El puente de hidrogeno es una union 10% covalente y 90% electros 10% debido a las superposiciones de los orbitales de union de los electrones compartidos 32

�El agua tiene puntos de fusion, ebullicion y vaporizacion mayores que cualquier otro solvente comun. 33

Hay un arreglo casi tetrahedrico de los pares de electrones en los orbitales externos alrededor del atomo de oxigeno, los dos atomos de hidrogeno presentan cargas positivas parciales localizadas y el atomo de oxigeno presenta una carga negativa parcial. Dos moleculas de agua unidas por un puente de hidrogeno (3 lineas) entre el oxigeno de la molecula superior y el hidrogeno de la inferior. Los puentes de hidrogeno son mas largos y mas debiles que los enlaces covalentes. 34

El agua es un solvente polar: Facilmente disuelve la mayoria de las biomoleculas cuales por lo general son polares o tienen carga electrica. Según a la respuesta de solvencia al agua los compuestos se clasifican en: 1. Compuestos Hidrofilicos: 2. Compuestos Hidrofobicos: 38

Compuestos Hidrofilicos: Los que se disuelven facilmente en agua Hydro: Agua Philos: amante Compuestos Hidrofobicos: Los que no se disuelven facilmente en agua, como ceras y grasas que son solubles en solventes no polares (cloroformo, benceno) Hydro: Agua Phobia: Temor 38

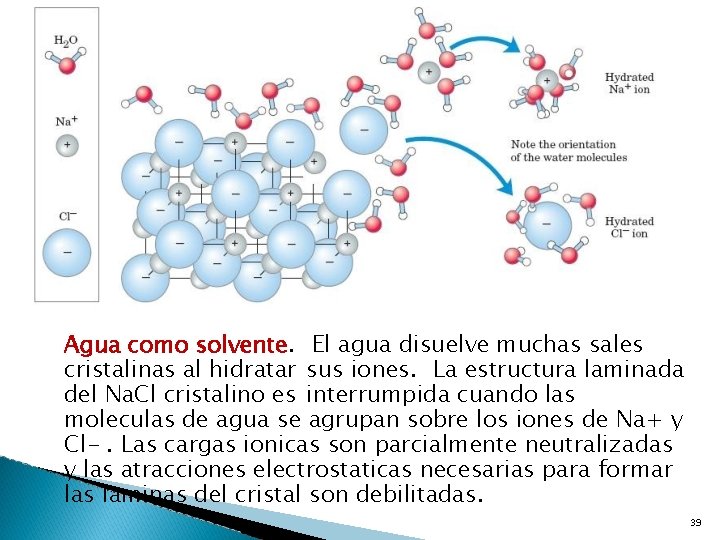
Agua como solvente. El agua disuelve muchas sales cristalinas al hidratar sus iones. La estructura laminada del Na. Cl cristalino es interrumpida cuando las moleculas de agua se agrupan sobre los iones de Na+ y Cl-. Las cargas ionicas son parcialmente neutralizadas y las atracciones electrostaticas necesarias para formar las laminas del cristal son debilitadas. 39

Compuestos anfipaticos: Son sustancias que contienen regiones polares (cargadas) y regiones no polares (sin carga). Cuando un compuesto anfipatico se mezcla con agua: � la region hidrofilica (polar) interactua favorablemente con el solvente y tiende a disolverse � las regiones polares se rearreglan para maximizar su interaccion con el solvente � las regiones hidrofobicas (no polares) se agrupan juntas para presentar la menor cantidad del area hidrofobica al solvente acuososo y 40

Muchas moleculas son anfipaticas: Proteinas, pigmentos, vitaminas, esteroles y fosfolipidos de las membranas tienen regiones polares y no polares Estructuras compuestas por estas moleculas son estabilizadas por interacciones hidrofobicas entre las regiones no polares Las interacciones hidrofobicas entre lipidos y proteinas son los determinantes estructurales mas importantes en las membranas biologicas Las interacciones hidrofobicas entre aminoacidos no polares estabilizan las estructuras tridimensionales de las proteinas 42

Cuando dos atomos no cargados se encuentran muy cerca, sus nubes electronicas se influencian una a la otra, los dos nucleos tienden a juntarse, pero sus nubes electronicas comienzan a repelerse. En el punto donde hay un balance exacto entre estas fuerzas de atraccion y de repulsion entre los nucleos se le conoce como punto de contacto de Van der Waals. 43

�El agua pura se encuentra levemente ionizada, formando igual numero de iones hidrogeno o hidronio (H+) y de iones hidroxilo (OH-). concentracion total de iones hidrogeno de todas las fuentes es experimentalmente medible yse expresa como el p. H de la solucion �La 44

�El p. H de una solucion acuosa refleja en escala logaritmica la concentracion de iones hidrogeno: p. H= log 1 [H+] = - log [H]. H+ = cationes de hidrogeno o protones p. H; de un solución es una medida de la concentración de los protones; como los protones reaccionan con el agua para dar iones hidronios 45

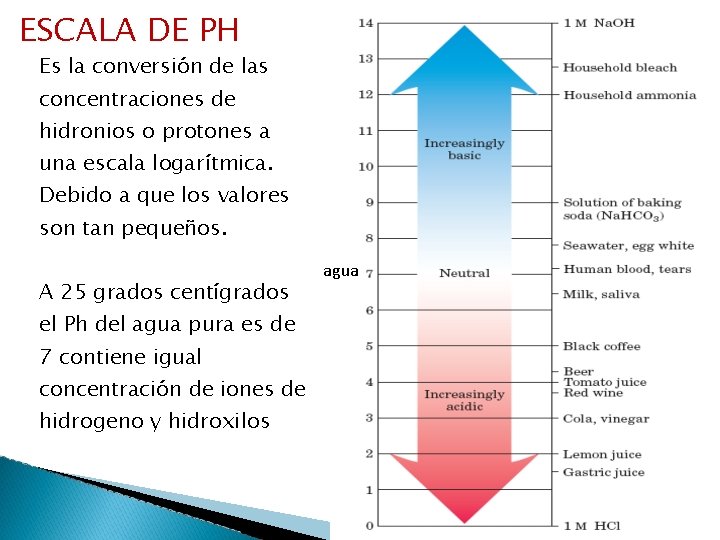
ESCALA DE PH Es la conversión de las concentraciones de hidronios o protones a una escala logarítmica. Debido a que los valores son tan pequeños. A 25 grados centígrados agua el Ph del agua pura es de 7 contiene igual concentración de iones de hidrogeno y hidroxilos 46

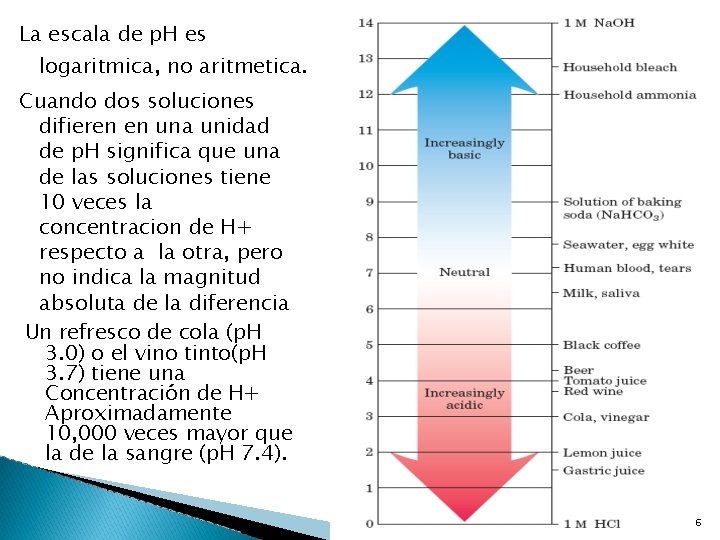
La escala de p. H es logaritmica, no aritmetica. Cuando dos soluciones difieren en una unidad de p. H significa que una de las soluciones tiene 10 veces la concentracion de H+ respecto a la otra, pero no indica la magnitud absoluta de la diferencia Un refresco de cola (p. H 3. 0) o el vino tinto(p. H 3. 7) tiene una Concentración de H+ Aproximadamente 10, 000 veces mayor que la de la sangre (p. H 7. 4). 46

Análisis final El agua es tanto el solvente en el cual ocurren las reacciones metabolicas asi como el reactante en muchos procesos bioquimicos: � Hidrolisis �Condensacion, �Reacciones de oxidacion-reduccion Ejemplo de Condensación de dos aminoácidos para formar un enlace peptídico. 47

Análisis final IMPORTANCIA DEL AGUA (función biológica) Las propiedades del agua permiten aprovechar esta molécula para algunas funciones para los seres vivos. Estas funciones son las siguientes: 1. Disolvente polar universal: 2. Lugar donde se realizan reacciones químicas: 3. Función de transporte: 4. Función amortiguadora: 5. Función termorreguladora: 47

Análisis final IMPORTANCIA DEL AGUA (función biológica) Disolvente polar universal: El agua, debido a su elevada constante dieléctrica, es el mejor disolvente para todas aquellas moléculas polares. 47

IMPORTANCIA DEL AGUA (función biológica) Análisis final Lugar donde se realizan reacciones químicas: Debido a ser un buen disolvente, por su elevada constante dieléctrica, y debido a su bajo grado de ionización. . 47

IMPORTANCIA DEL AGUA (función biológica) Análisis final Función estructural: Por su elevada cohesión molecular, el agua confiere estructura, volumen y resistencia. . 47

Análisis final IMPORTANCIA DEL AGUA (función biológica) · Función amortiguadora: Debido a su elevada cohesión molecular, el agua sirve como lubricante entre estructuras que friccionan y evita el rozamiento. 47

IMPORTANCIA DEL AGUA (función biológica) Análisis final · Función termorreguladora: Al tener un alto calor específico y un alto calor de vaporización el agua es un material idóneo para mantener constante la temperatura, absorbiendo el exceso de calor o cediendo energía si es necesario. 47

IMPORTANCIA DEL AGUA (función biológica) Análisis final · CUIDEMOS EL AGUA 47
 Afiche tipo de texto
Afiche tipo de texto Irrigacion del pancreas
Irrigacion del pancreas Principal religión de áfrica
Principal religión de áfrica Generalidades del sistema cardiovascular
Generalidades del sistema cardiovascular Ciclo de vida entamoeba histolytica
Ciclo de vida entamoeba histolytica Generalidades de las proteinas
Generalidades de las proteinas Ejemplos de generalidades en un trabajo
Ejemplos de generalidades en un trabajo Generalidades de los materiales dentales
Generalidades de los materiales dentales Instalaciones y sistemas industriales
Instalaciones y sistemas industriales Protozoarios
Protozoarios Norma 17025 vigente
Norma 17025 vigente Dibujos sobre
Dibujos sobre Generalidades de las normas iso
Generalidades de las normas iso Zycomycotina
Zycomycotina Generalidades de la administración financiera
Generalidades de la administración financiera Generalidades del metabolismo
Generalidades del metabolismo Generalidades de la lectura
Generalidades de la lectura Generalidades de las proteinas
Generalidades de las proteinas Que son las generalidades de una empresa
Que son las generalidades de una empresa Generalidades de la mecanica corporal
Generalidades de la mecanica corporal Características de la prospectiva
Características de la prospectiva Talo en hongos
Talo en hongos Bicondilea
Bicondilea Generalidades del reino fungi
Generalidades del reino fungi Generalidades de las fuentes del derecho escrito
Generalidades de las fuentes del derecho escrito Generalidades de los hidrocarburos
Generalidades de los hidrocarburos Generalidades sobre funções
Generalidades sobre funções Generalidades de la prospectiva
Generalidades de la prospectiva Generalidades de la irrigación
Generalidades de la irrigación Cuspides segundo molar inferior
Cuspides segundo molar inferior Matriz de expansion de productos y mercado
Matriz de expansion de productos y mercado Ciclo biologico de entamoeba histolytica
Ciclo biologico de entamoeba histolytica Generalidades de una empresa
Generalidades de una empresa Generalidades de la administración financiera
Generalidades de la administración financiera Botrias
Botrias Generalidades de los esporozoarios
Generalidades de los esporozoarios Generalidades de las proteinas
Generalidades de las proteinas Generalidades de la estadistica
Generalidades de la estadistica