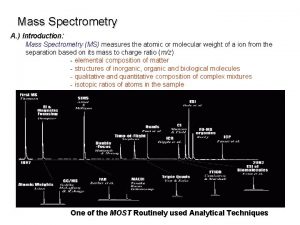
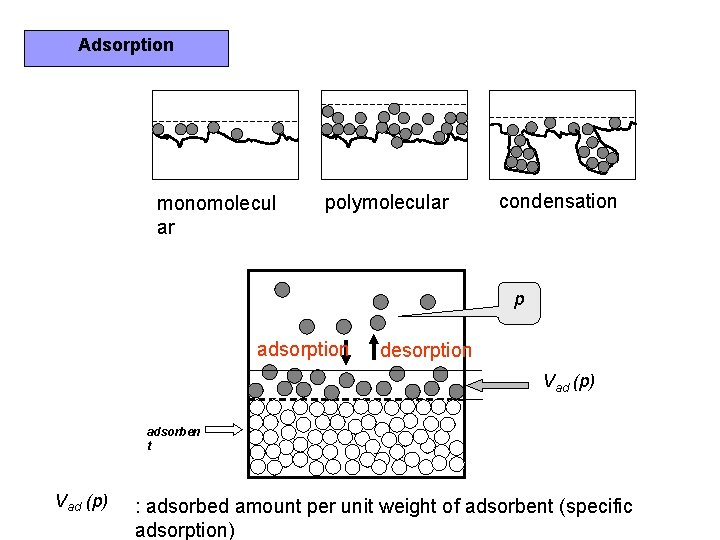
Adsorption monomolecul ar polymolecular condensation p adsorption desorption





- Slides: 11


Adsorption monomolecul ar polymolecular condensation p adsorption desorption Vad (p) adsorben t Vad (p) : adsorbed amount per unit weight of adsorbent (specific adsorption)

A gázadszorpció szükségszerűen exoterm, azaz növekvő hőmérséklet csökkenő adszorpcióhoz vezet egyensúlyban. Az entrópia csökken!

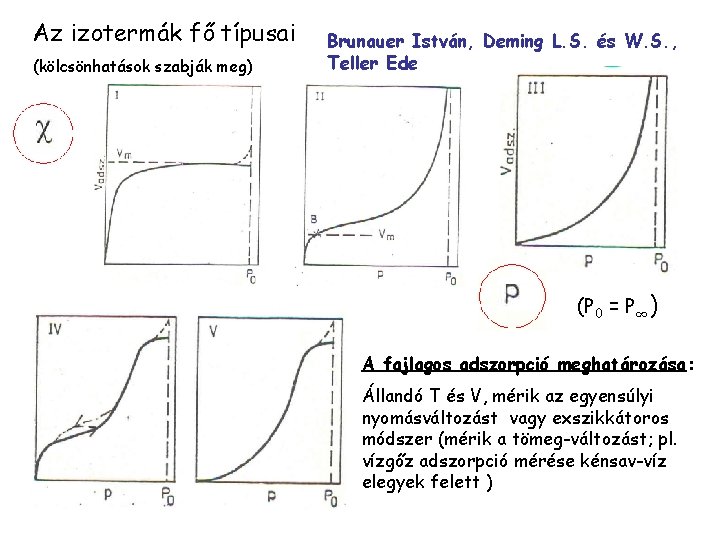
Az izotermák fő típusai (kölcsönhatások szabják meg) Brunauer István, Deming L. S. és W. S. , Teller Ede (P 0 = P∞) A fajlagos adszorpció meghatározása: Állandó T és V, mérik az egyensúlyi nyomásváltozást vagy exszikkátoros módszer (mérik a tömeg-változást; pl. vízgőz adszorpció mérése kénsav-víz elegyek felett )

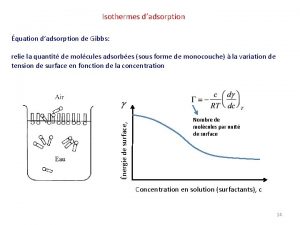
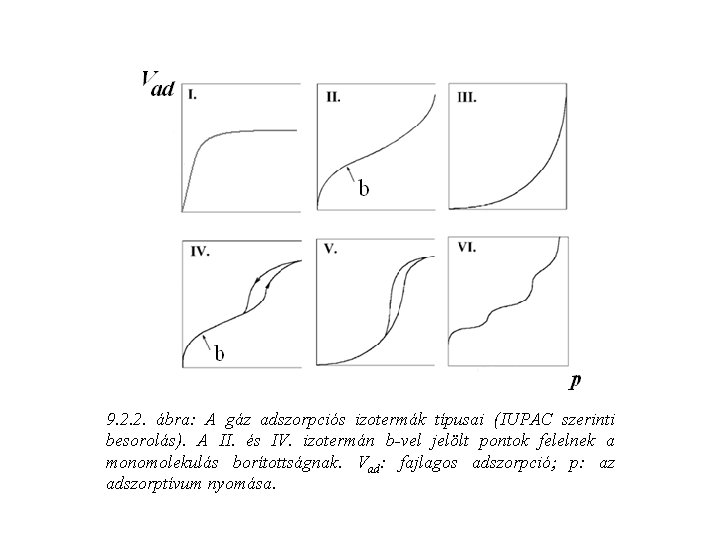
9. 2. 2. ábra: A gáz adszorpciós izotermák típusai (IUPAC szerinti besorolás). A II. és IV. izotermán b-vel jelölt pontok felelnek a monomolekulás borítottságnak. Vad: fajlagos adszorpció p: az adszorptívum nyomása.

Izoterma egyenletek: fajlagos felület meghatározása Langmuir-izoterma és egyenlet (kinetikai levelezetés) Dinamikus egyensúlyban: Feltételek: Monomolekulás borítottság Adszorpció aktív centrumokon történik A diff. adszorpciós hő független a borítottságtól (ritkán teljesül) Langmuir izoterma-egyenlet (l. korábban a Gibbs- és Szyszkowski egyenletek összevetéséből) χm: a monomolekulás adszorpció

Linearizálva: as: fajlagos felület (m 2/g) φ: adszorptívum fajlagos felületigénye (m 2/mol)

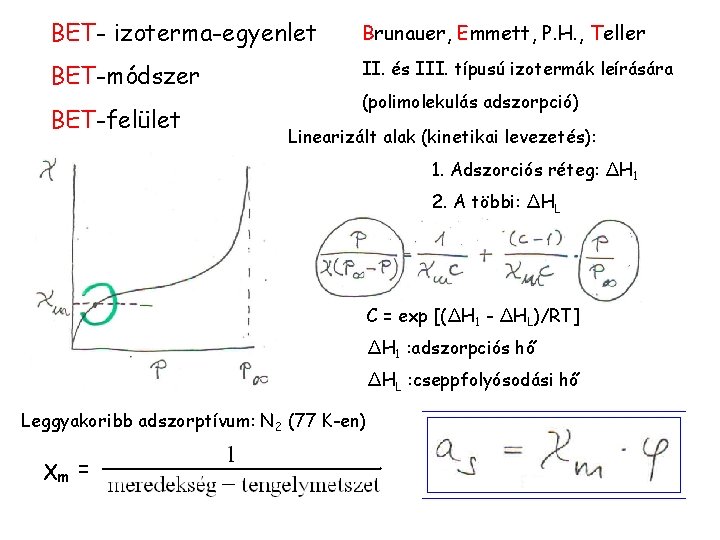
BET- izoterma-egyenlet Brunauer, Emmett, P. H. , Teller BET-módszer II. és III. típusú izotermák leírására BET-felület (polimolekulás adszorpció) Linearizált alak (kinetikai levezetés): 1. Adszorciós réteg: ΔH 1 2. A többi: ΔHL C = exp [(ΔH 1 - ΔHL)/RT] ΔH 1 : adszorpciós hő ΔHL : cseppfolyósodási hő Leggyakoribb adszorptívum: N 2 (77 K-en) χm =

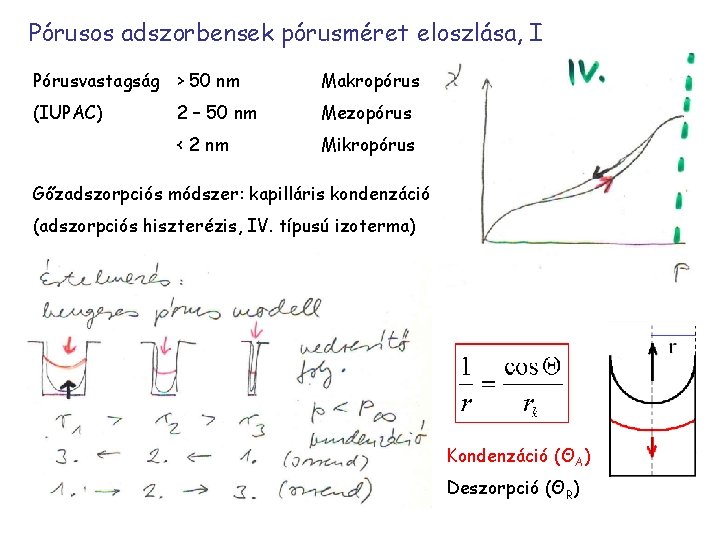
Pórusos adszorbensek pórusméret eloszlása, I Pórusvastagság > 50 nm Makropórus (IUPAC) 2 – 50 nm Mezopórus < 2 nm Mikropórus Gőzadszorpciós módszer: kapilláris kondenzáció (adszorpciós hiszterézis, IV. típusú izoterma) Kondenzáció (ΘA) Deszorpció (ΘR)

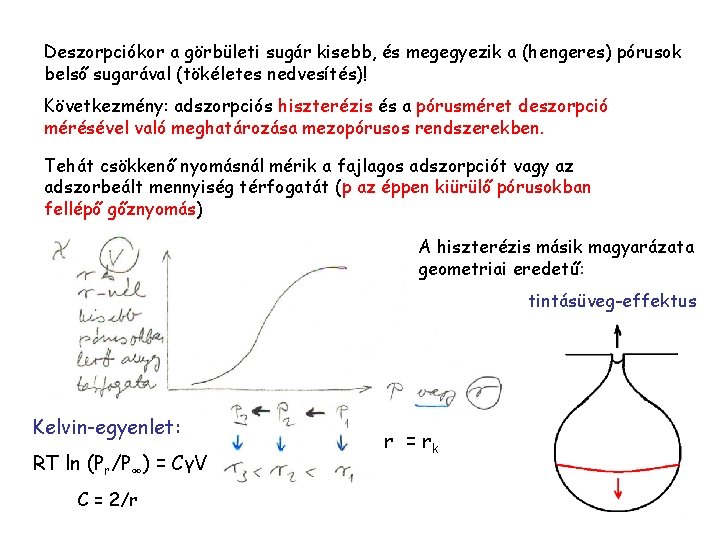
Deszorpciókor a görbületi sugár kisebb, és megegyezik a (hengeres) pórusok belső sugarával (tökéletes nedvesítés)! Következmény: adszorpciós hiszterézis és a pórusméret deszorpció mérésével való meghatározása mezopórusos rendszerekben. Tehát csökkenő nyomásnál mérik a fajlagos adszorpciót vagy az adszorbeált mennyiség térfogatát (p az éppen kiürülő pórusokban fellépő gőznyomás) A hiszterézis másik magyarázata geometriai eredetű: tintásüveg-effektus Kelvin-egyenlet: RT ln (Pr/P∞) = CγV C = 2/r r = rk

Pórusos adszorbensek pórusméret eloszlása, II Hg-porozimetria (hengeres pórusmodell) Vákumozás után mért mennyiségek: Bepréselt Hg térfogata (V) Alkalmazott nyomás (p) Ismerni kell a Hg felületi feszültségét és peremszögét a kérdéses felszínen. →
 Quadrupole mass analyzer
Quadrupole mass analyzer Bubble method for soft gelatin capsule
Bubble method for soft gelatin capsule Fajans method
Fajans method Mechanism of adsorption chromatography
Mechanism of adsorption chromatography Positive adsorption
Positive adsorption Isotherme de gibbs
Isotherme de gibbs What is adsorption
What is adsorption Adsorption technique in blood banking
Adsorption technique in blood banking Adsorption introduction
Adsorption introduction Chromatography mobile phase and stationary phase
Chromatography mobile phase and stationary phase Bet equation
Bet equation Langmuir adsorption isotherm
Langmuir adsorption isotherm