ACIDO URICO E RISCHIO CARDIOVASCOLARE MARKER o CONCAUSA





























- Slides: 38

ACIDO URICO E RISCHIO CARDIOVASCOLARE : MARKER o CONCAUSA? Dr. Leotta Vincenzo ASL 2 Olbia L’acido urico (AU) rappresenta il prodotto finale del metabolismo purinico e dell’attività della xantino-ossidasi; questo enzima tende ad aumentare lo stress ossidativo e la produzione di radicali liberi dell’ossigeno che sono direttamente responsabili della produzione di citochine e dell’apoptosi e disfunzione endoteliale. Il percorso di produzione dell’AU inoltre può favorire l’ossidazione delle lipoproteine e l’aggregazione piastrinica, con ovvio potenziamento dell’attività aterotrombotica e facilitazione nell’insorgenza e nella progressione della malattia coronarica e dello stato ipertensivo. La tendenza dell’iperuricemia cronica con e senza deposito di cristalli di urato a combinarsi con i diversi fattori di rischio cardiovascolare, dall’ipertensione all’obesità, al diabete, e con le malattie cardiovascolari e renali è nota da oltre un secolo. A partire dagli anni Cinquanta-Sessanta un numero crescenti di studi epidemiologici ha dimostrato la stretta associazione tra i livelli circolanti di acido urico e malattie cardiovascolari. L’importanza di questa associazione è però controversa alcuni gruppi di esperti come quelli del Framingham Heart Study non considerano l’AU un fattore di rischio, invitando i medici a considerare solo i fattori di rischio classici nella valutazione del paziente, e linee guida autorevoli, come la JNC 7 non lo considerano un fattore di rischio cardiovascolare. Nata come malattia prevalentemente delle articolazioni, l’iperuricemia cronica con deposito di cristalli di urato nel corso degli ultimi anni è stata associata sempre più spesso alle malattie cardiovascolari, cerebrali e renali di cui condiziona in modo rilevante la prognosi: cardiopatia ischemia, scompenso cardiaco, ictus, deterioramento cognitivo, insufficienza renale. Luigi XIV

Sebbene il ruolo dell’AU non sia stato ben definito, è ipotizzabile che questa sostanza possa essa stessa costituire un fattore di rischio cardiovascolare o divenire un mediatore di altri fattori di rischio come l’ipertensione, il diabete e la dislipidemia può inoltre avere una parte Importante nell’incidenza dello stroke, nel peggioramento dello scompenso cardiaco e nell’insorgenza della malattia renale. I valori di AU tendono ad essere significativamente piu’elevati nell’uomo che nella donna, gli episodi gottosi sono cinque volte piu’ frequenti nell’uomo. La maggioranza dei pazienti con iperuricemia non sviluppa gotta conclamata: l’incidenza annuale di questa dolorosa artrite è stata stimata essere solo il 5%nei pazienti con livelli di AU superiori a 9 mg/dl. L’aumento di rischio cardiovascolare osservato nei gruppi etnici che assumono uno stile d vita Occidentale, che emigrano nelle nazioni occidentali, o che si spostano da aree rurali a urbane, correla con l’aumento dell’AU. Il brusco incremento di ipertensione, obesità, diabete e malattia renale osservato negli USA negli ultimi 100 anni è stato pure associato a un progressivo aumento dell’uricemia: da meno di 3. 5 negli anni venti a 6 -6. 5 mg/dl negli anni settanta, con valori inferiori di 0. 5 -1 mg circa nelle donne, probabilmente per effetto uricosurico degli estrogeni.

Già nel 1897 Davis, nella suo discorso presidenziale alla American Medical Association scriveva “High arterial tension in gout is due in part to uric acid or other toxic substances in the blood which increase the tonus of the [renal] arterioles” pur non avendo mai potuto dimostrare nella sua carriera un ruolo causale dell’acido urico in quanto a quei tempi non erano ancora disponibili farmaci efficaci nel ridurre l’uricemia. Se si considera che la clinica della iperuricemia non si esaurisce nella classiche manifestazioni da deposito articolare (artrite) o extraarticolare (tofi) appare evidente come debba essere posta particolare attenzione alla iperuricemia cronica oltre che alla gotta per sè. Per questo motivo si parla sempre più spesso di iperuricemia cronica con e senza deposito di urati ad indicare che anche indipendentemente dai segni clinici della gotta il monitoraggio dei livelli di acido urico, nel contesto del quadro cardiovascolare e renale globale del paziente, sia decisamente opportuno.

Iperuricemia e Gotta: una relazione “complessa” Non necessariamente un iperuricemico è anche un gottoso nè un gottoso è necessariamente iperuricemico. Ø Frequenza dell’iperuricemia: 20 – 25% Ø Frequenza della gotta: 1 -3% (paesi occidentali) Ø Rapporto Iperuricemia : gotta = 10 : 1 La dieta ha un ruolo non trascurabile, sia pur meno importante di quanto ipotizzato nel passato, nel favorire l’iperuricemia. Il consumo di carne, pesce, frutti di mare e di cibi ad alto contenuto di fruttosio e l’assunzione di birra e, più in generale, di alcolici aumentano i livelli di acido urico sia pur in modo non clamoroso. Ciò rende ragione di come nei paesi occidentali l’uricemia media sostanzialmente raddoppiata dagli inizi del Novecento ai giorni nostri con un trend in ulteriore aumento. Voltaire

Sebbene l’uricasi (urato-ossidasi), che trasforma l’acido urico nella più solubile allantoina, sia presente in quasi tutti gli organismi viventi, (vertebrati, invertebrati, batteri, funghi, piante), è assente in molti primati (in particolare nell’uomo) e nei cani dalmata. Nel genoma umano è presente un gene per l'urato ossidasi, reso non funzionale da due mutazioni. Secondo alcuni studi di paleontologia genetica la perdita del gene dell’uricasi, probabilmente verificatasi nel Miocene, in un periodo quindi compreso fra 10 e 20 milioni di anni fa, avrebbe rappresentato un vantaggio evolutivo in un momento in cui i primati che si alimentavano con cibi vegetali, e quindi poveri di sale, stavano assumendo la posizione eretta. L’aumento dell'uricemia conseguente alla scomparsa dell'uricasi avrebbe compensato l'iponatremia favorendo il mantenimento o l’innalzamento della pressione arteriosa rendendola, quindi, più adeguata all'ortostatismo. Un ulteriore beneficio deriverebbe dal fatto che l'acido urico, essendo un potente antiossidante, sarebbe in grado di contrastare i radicali liberi, aumentando l'aspettativa di vita e riducendo l'incidenza dei tumori.

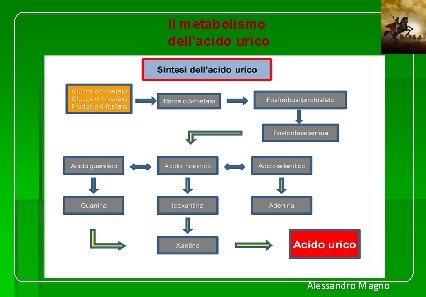
Il metabolismo dell’acido urico Alessandro Magno

L’acido urico rappresenta, nell’uomo, il prodotto finale urinario del metabolismo delle purine. La concentrazione di acido urico nei liquidi corporei è il risultato dell’equilibrio tra ritmo di produzione e velocità di escrezione. Nell’uomo la quantità di acido urico è di 1, 2 grammi (poco più della metà nella donna), con un turnover giornaliero di circa 0, 7 grammi, di cui circa 2/3 escreti per via urinaria ed 1/3 per via intestinale (secrezione biliare, gastrica e intestinale). La forma circolante di acido urico è costituita quasi interamente dallo ione urato. A p. H fisiologico ed a normale temperatura il limite di solubilità dell'urato è 6, 8 mg/dl. A livello intestinale, la flora batterica residente degrada l’acido urico mediante un processo di uricolisi. Le purine endogene rappresentano la principale fonte di acido urico, con incremento nella produzione dipendente dall’attività sintetica e dal riciclo delle stesse. L’altra fonte di acido urico, quantitativamente minore, è rappresentata dalle purine esogene, introdotte con la dieta, mentre una piccola quota è di derivazione catabolica tissutale.

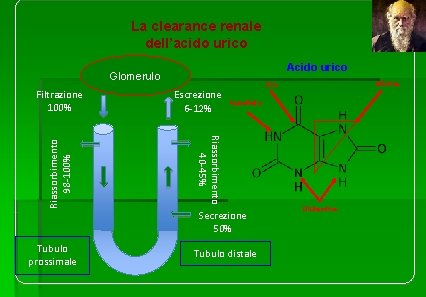
La clearance renale dell’acido urico Acido urico Glomerulo Escrezione 6 -12% Aspartato Secrezione 50% Tubulo prossimale Glicina CO 2 Riassorbimento 40 -45% Riassorbimento 98 -100% Filtrazione 100% Tubulo distale Glutamina

L’acido urico è una molecola idrosolubile, con un basso legame con le proteine plasmatiche (circa 5%). Viene eliminato dal rene per mezzo di un complesso meccanismo. L’urato è filtrato liberamente dal glomerulo e oltre il 90% della quota filtrata viene attivamente riassorbito nel tubulo prossimale, in gran parte grazie ad uno specifico trasportatore denominato URAT-1. Nelle porzioni successive del tubulo, l’urato va incontro a secrezione attiva e a nuovo riassorbimento attivo, cosicché il risultato finale è una secrezione urinaria di urato pari a circa il 6 -12% della quantità filtrata. I fenomeni di secrezione e riassorbimento attivi sono sensibili a numerosi molecole. Fattori che influenzano la clearance renale dell’urato: Ø riassorbimento tubulare di glucosio, fosfati, calcio, bicarbonato Ø secrezione di acidi organici Ø estrogeni (riducono l’escrezione di acido urico) Ø flusso plasmatico renale sodio,

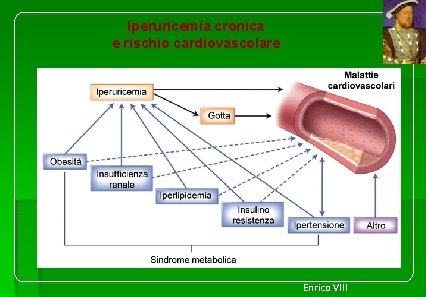
Iperuricemia cronica e rischio cardiovascolare Enrico VIII

Numerose evidenze scientifiche suggeriscono come l’iperuricemia cronica con e senza deposito di cristalli di urato sia un fattore di rischio indipendente per lo sviluppo di ictus, infarto del miocardio e malattia arteriosa periferica. L’iperuricemia si colloca in una posizione di rilievo nello scenario fisiopatologico delle malattie cardiovascolari in ragione della frequente associazione con altri fattori di rischio cardiovascolare e di una probabile lesività diretta a livello vascolare dell’acido urico nel paziente iperuricemico. Alcune interessanti evidenze scientifiche hanno dimostrato in modo convincente l’esistenza di una relazione tra i livelli circolanti di acido urico e la presenza di disfunzione endoteliale, ossia di una compromissione della capacità delle arterie di modulare il proprio tono vasomotore, espressione precoce di danno vascolare.

EFFETTI TOSSICI DELL’AU SUL SISTEMA VASCOLARE: STUDI SPERIMENTALI In un modello sperimentale nel ratto, reso iperuricemico mediante la somministrazione di acido oxonico, un inibitore dell’enzima uricasi, rende i ratti incapaci di metabolizzare l’AU ad allantoina. I ratti cosi’ trattati non solo diventano iperuricemici, ma sviluppano anche ipertensione con un meccanismo legato da un lato allo sviluppo di arteriosclerosi con inibizione della liberazione di ossido nitrico (ON) e attivazione del RAS, dall’altro allo sviluppo di sodio-sensibilità. Esami autoptici dimostrano lo sviluppo di un danno vascolare renale, caratterizzato da vasocostrizione corticale, ispessimento dell’arteriola afferente e ipertensione glomerulare. Tali alterazioni risultavano almeno parzialmente reversibili dopo somministrazione di un inibitore del RAS: infatti, cellule muscolari lisce vascolari incubate con AU andavano incontro a proliferazione, produzione di angiotensina II e incremento dello stress ossidativo, effetti che venivano prevenuti dal trattamento con captopril o losartan che aumenta l’escrezione urinaria di urato inibendo l’assorbimento renale mediato dall’URAT-1. L’AU può esercitare un effetto vasocostrittore mediato dall’endotelina-1. Cellule muscolari liscie provenienti dall’aorta umana, incubate con crescenti concentrazioni di AU, vanno incontro a proliferazione e a un’accresciuta espressione di endotelina-1, monocyte chemoattractan che richiama macrofagi a infiltrare la parete dei vasi aterosclerotici. Osservazioni simili sono state riprodotte su fibroblasti di origine umana.

Acido urico e ipertensione Svariati studi di popolazione hanno stabilito un’associazione abbastanza forte fra livelli di uricemia e ipertensione nell’uomo. Anche se non si può escludere l’effetto di fattori di confondimento, nella maggior parte degli studi i risultati sono stati aggiustati per covariate, quali l’uso di diuretici, fattori dietetici e consumo di alcool. In uno studio 30 adolescenti con ipertensione essenziale, non sottoposti in precedenza ad alcuna terapia farmacologica, e con uricemia >6. 0 mg/dl sono stati randomizzati a ricevere allopurinolo o placebo. Nel gruppo trattato, si assisteva ad una riduzione dei valori pressori(valutati mediante monitoraggio ambulatoriale) con normalizzazione in circa il 70% dei casi, mentre, nel gruppo di controllo, i valori si normalizzavano in un solo paziente. Inoltre, l’attività reninica plasmatica si riduceva solo nel gruppo sottoposto a trattamento attivo, fornendo supporto all’ipotesi che l’azione tossica dell’AU possa esplicarsi attraverso il RAS. Lo studio LIFE condotto su soggetti ipertesi con ipertrofia del VS, ha dimostrato la superiorità di losartan vs atenololo nella riduzione di morbilità e mortalità cardiovascolare. Alla fine dello studio l’AU è risultato maggiore nei soggetti trattati con atenololo rispetto a quelli trattati con losartan; trattamento con quest’ultimo farmaco ha ridotto del 29%gli endpoint compositi con evidenza statistica significativa per il sesso femminile. Sembra dunque che il trattamento con losartan sia efficace nel ridurre l’iperuricemia, determinando così un effetto protettivo a livello cardiaco e renale.

EFFETTI DEL FRUTTOSIO Negli ultimi 200 anni c’è stato un grande aumento di consumo di fruttosio nei paesi sviluppati, contemporaneo all’aumento di ipertensione e obesità. Il fruttosio, rispetto ad altri zuccheri, induce iperuricemia stimolando la conversione di ATP epatico ad ADP tramite la fruttochinasi; al consumo di ATP corrisponde un accumulo di AMP che attivando l’AMP deaminasi porta alla sintesi di AU. Dati sperimentali sostengono l’ipotesi di un collegamento tra assunzione di fruttosio iperuricemia e aumento dei valori pressori. Studi epidemiologici hanno pure collegato l’assunzione di fruttosio, e aumentato rischio di iperuricemia e sindrome metabolica. La somministrazione di diete ricche di fruttosio può indurre molte caratteristiche della sindrome metabolica, compreso un aumento acuto dei valori pressori. Quindi, l’iperuricemia indotta da fruttosio potrebbe avere un ruolo nell’aumento mondiale di prevalenza dell’ipertensione. Anche l’ingestione di altri alimenti ( come pasti ricchi di purine) bevande ( birra) o l’esposizione a tossici ( piombo )possono contribuire ad aumentare i valori dell’AU, e portare a ipertensione”iperuricemica ”. ipertensione”iperuricemica”.

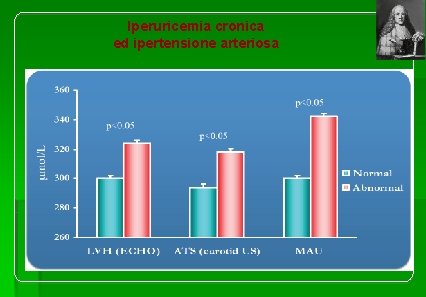
Iperuricemia cronica ed ipertensione arteriosa

Il paziente iperteso ipeuricemico mostra spesso un più evidente danno d’organo rispetto al normouricemico (Figura tratta da Viazzi F, et al. Hypertension 2005; 45: 991 -6). Una recente metanalisi che ha incluso 18 studi per un totale di oltre 55. 000 partecipanti ha dimostrato per ogni mg/dl di incremento di uricemia un parallelo aumento del rischio di sviluppare ipertensione pari a 1. 13 (intervallo di confidenza al 95% compreso tra 1. 06 e 1. 20). Lo studio PIUMA condotto su 1720 ipertesi seguiti in follow up per 12 anni, ha evidenziato che un valore di AU elevato( 4° quartile vs 2° quartile) determina un incremento di eventi fatali e di morte per tutte le cause. Lo studio WORKSITE TREATMENT PROGRAM ha valutato il rapporto tra AU ed eventi cardiovascolari nel soggetto iperteso su 8690 ipertesi. La riduzione dell’uricemia di 1 mg/dl era associata ad una riduzione di eventi del 32% ed era comparabile ad un calo del colesterolo totale di 46 mg/dl o della PA di 10 mm. Hg.

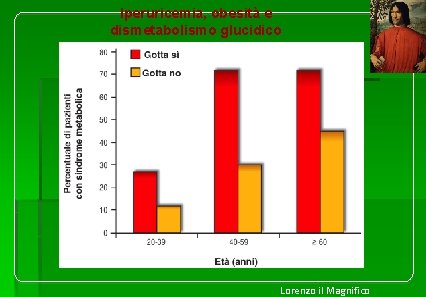
Iperuricemia, obesità e dismetabolismo glucidico Lorenzo il Magnifico

La prevalenza di sindrome metabolica è significativamente aumentata nei pazienti con iperuricemia cronica con deposito di cristalli di urato (Figura tratta da Choi HK, et al. Arthritis Rheum 2007; 57: 109 -15. ). Il frequente riscontro di elevati livelli di acido urico nei pazienti con sindrome metabolica è stato attribuito alla presenza di iperinsulinemia in quanto l’insulina riduce l’escrezione renale di acido urico. L’iperuricemia, tuttavia, spesso precede la comparsa dell’iperinsulinemia, dell’obesità e del diabete e può essere presente anche nei pazienti con sindrome metabolica non obesi. La presenza di livelli di uricemia anche solo moderatamente aumentati (>5. 3 mg/d. L nelle donne e >7. 0 mg/d. L negli uomini) è associata anche a un significativo aumento del rischio di sviluppare diabete mellito di tipo 2 (hazard ratio: 2. 78 con un intervallo di confidenza al 95% compreso tra 1. 35 e 5. 70, p = 0. 0054). In un recente studio epidemiologico condotto su soggetti diabetici, l’AU elevato si dimostrava come importante predittore di mortalità. In questa coorte di 535 diabetici, seguiti dal 1998 al 2004, un incremento di 1 mg/dl di AU era associato a un incremento di mortalità del 41%, e una maggiore predittività di mortalità si aveva per valori di Hb. A 1 c < 9 mg/dl mentre lo era meno per valori >9 mg/dl.

ACIDO URICO E RENE ( IRC ) Nel 1928 Gudzent descriveva una “ nefropatia gottosa” che veniva riscontrata nel 79 -99% dei pazienti all’autopsia, caratterizzata da fibrosi interstiziale, glomerulosclerosi e ispessimento delle pareti arteriolari con fibrosi intimale. Diversi studi epidemiologici hanno stabilito un legame fra elevati livelli serici di AU e successivo sviluppo di CKD. Due studi di popolazione giapponese hanno dimostrato una significativa relazione fra livelli di AU e CKD: Nel primo condotto su 6403 soggetti, livelli di uricemia superiori a 8. 0 mg/dl conferivano un rischio di sviluppare CKD 2. 9 volte superiore negli uomini e 10. 4 volte nelle donne, rispetto ai soggetti con valori basali <5. 0 mg/dl. Nel secondo studio a cui prendevano parte 48177 soggetti, con un follow up di 7 anni, un’uricemia superiore a 7. 0 mg/dl comportava un significativo rischio di sviluppare una malattia renale terminale pari a 2. 31 negli uomini e a 5. 87 nelle donne. Studi recenti mostrano che la riduzione dei valori uricemia trattando l’iperuricemia asintomatica , può rallentare la progressione della malattia renale, e migliorare la funzionalità renale. In un altro studio, la sopensione di allopurinolo a gruppi di soggetti con CKD stabilizzata, ha peggiorato l’ipertensione e accelerato l’insufficienza renale nei pazienti che non assumevano ACEI.

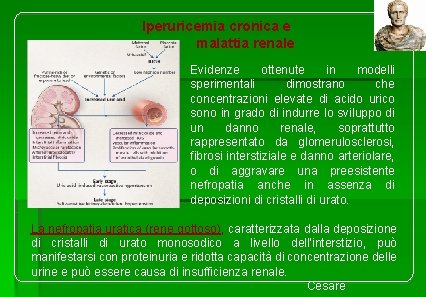
Iperuricemia cronica e malattia renale Evidenze ottenute in modelli sperimentali dimostrano che concentrazioni elevate di acido urico sono in grado di indurre lo sviluppo di un danno renale, soprattutto rappresentato da glomerulosclerosi, fibrosi interstiziale e danno arteriolare, o di aggravare una preesistente nefropatia anche in assenza di deposizioni di cristalli di urato. La nefropatia uratica (rene gottoso), caratterizzata dalla deposizione di cristalli di urato monosodico a livello dell’interstizio, può manifestarsi con proteinuria e ridotta capacità di concentrazione delle urine e può essere causa di insufficienza renale. Cesare

Il danno renale da iperuricemia è rappresentato anche da: Litiasi renale, estremamente frequente nei gottosi ed è proporzionale alla quantità di acido urico escreto. Nefropatia da acido urico, appannaggio dei pazienti in chemioterapia, è un quadro di insufficienza renale acuta provocato dalla massiccia precipitazione di cristalli di urato monosodico a livello dei tubuli, dei dotti collettori, dei bacinetti e degli ureteri. Generalmente è reversibile. In uno studio di recentissima pubblicazione i soggetti affetti da iperuricemia cronica con deposito di urato hanno mostrato un’incidenza dell’insorgenza di End State Renal Disease significativamente più alta (p<0. 001) rispetto a quelli che non presentavano tale condizione clinica. Il rischio dell’insorgenza di insufficienza renale terminale è risultato soprattutto aumentato nei soggetti con età >45 anni (Kuang-Hui Yu et al. Arthritis Research & Therapy 2012).

Iperuricemia cronica ed eventi cardiovascolari Karl Marx

Nel Preventive Cardiology Information System (Pre. CIS) Database Cohort Study sono stati osservati livelli sierici di acido urico significativamente maggiori nei pazienti con pregressa diagnosi di coronaropatia rispetto al resto dei pazienti studiati (6. 3± 1. 7 mg/d. L versus 5. 9± 1. 6 mg/d. L; p < 0. 001). Analizzando i dati degli oltre 3000 pazienti arruolati nello studio Pre. CIS è risultato evidente come il rischio di mortalità crescesse gradualmente all’aumentare dell’uricemia, risultando significativamente superiore nel gruppo di pazienti appartenenti al quartile più alto (7. 1 -13. 9 mg/d. L) rispetto a quelli appartenenti al quartile più basso (0. 4 -4. 9 mg/d. L) di uricemia (Figura tratta da Ioachimescu AG et al. Arthirtis & Rheumatism 2008: 58: 623 -30. ). Già a partire dal terzo anno di follow-up è stato osservato un incremento del rischio di mortalità per tutte le cause pari al 39% per ogni singolo incremento di 1 mg/d. L di acido urico sierico (intervallo di confi denza al 95% compreso tra 1. 28 e 1. 50; p < 0. 001).

Iperuricemia cronica e mortalità cardiovascolare Clemente VII

Lo studio NHANES I ha dimostrato una più elevata mortalità cardiovascolare nei pazienti con più elevati livelli di uricemia (Figura tratta da Fang J, et al. JAMA 2000; 283: 2404 -10). È interessante notare come la relazione tra acido urico e malattie cardiovascolari sia evidente non solo in condizioni di franca iperuricemia ma anche per livelli di uricemia nel range di normalità o ai limiti alti della norma, sia in nei soggetti sani che in quelli con anamnesi positiva per malattie cardiovascolari.

L’iperuricemia cronica è associata ad aumentata mortalità nello scompenso cardiaco

L’iperuricemia rappresenta anche un predittore indipendente di prognosi sfavorevole nei pazienti con scompenso cardiaco lievemoderato (Figura tratta da Anker SD, et al. Circulation 2003; 107: 1991 -97. ). La presenza di depositi di cristalli di urato rappresenta un importante determinante dell’aumentato rischio cardiovascolare nei pazienti con iperuricemia cronica. Nello studio di Framingham, nei pazienti iperuricemici cronici la presenza di deposito di cristalli di urato era associata a un aumento di due volte del rischio di sviluppare eventi coronarici rispetto ai pazienti senza depositi.

Trattamento dell’iperuricemia cronica: gli inibitori della xantino-ossidasi Carl von Linnè

La xantina ossidasi, enzima flavinico che catalizza la conversione della xantina in acido urico, è il target enzimatico dei farmaci che interferiscono con la sintesi di acido urico. Gli inibitori della xantina ossidasi arrestano il metabolismo delle purine alla formazione di ipoxantina e di xantina, intermedi metabolici che vengono quindi eliminati come tali. Proprio in ragione del loro meccanismo di azione questi farmaci possono essere utilizzati nell’iperuricemia indipendentemente dalle cause di iperproduzione di acido urico e si sono dimostrati efficaci sia negli iperproduttori che negli ipoescretori e rappresenta di fatto il trattamento abituale del'iperuricemia.

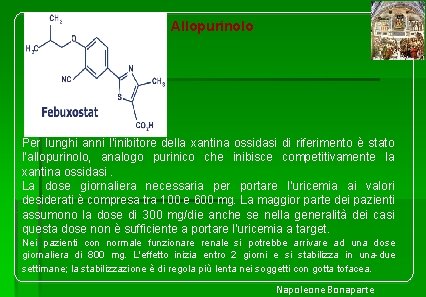
Allopurinolo Per lunghi anni l’inibitore della xantina ossidasi di riferimento è stato l’allopurinolo, analogo purinico che inibisce competitivamente la xantina ossidasi. La dose giornaliera necessaria per portare l'uricemia ai valori desiderati è compresa tra 100 e 600 mg. La maggior parte dei pazienti assumono la dose di 300 mg/die anche se nella generalità dei casi questa dose non è sufficiente a portare l’uricemia a target. Nei pazienti con normale funzionare renale si potrebbe arrivare ad una dose giornaliera di 800 mg. L'effetto inizia entro 2 giorni e si stabilizza in una-due settimane; la stabilizzazione è di regola più lenta nei soggetti con gotta tofacea. Napoleone Bonaparte

Allopurinolo viene metabolizzato ad ossipurinolo, metabolita attivo che viene eliminato dal rene, cosa che impone una netta riduzione della dose di allopurinolo in presenza di insufficienza renale. Allopurinolo è efficace nel prevenire le ricorrenze di gotta e nel favorire la regressione dei tofi, a condizione che il target terapeutico venga raggiunto. L’uso di allopurinolo può essere gravato da reazioni indesiderate soprattutto a carico dell’apparato gastroenterico (nausea, vomito, diarrea), della cute (eruzioni cutanee ma anche casi di necrolisi epidermica tossica e di sindrome di Stevens-Johnson) e del sistema emopoietico (leuco- e trombocitopenia). Sono stati descritti anche vasculiti, nefriti interstiziali e casi di urolitiasi e di cristalluria (cristalli di xantina e di ossipurinolo) in soggetti con uricuria particolarmente elevata e una sindrome da ipersensibilità molto rara, ma con una letalità del 25% dei casi, che sembra favorita dalla presenza di insufficienza renale e dall'uso di diuretici.

Febuxostat A differenza dell’allopurinolo e del suo metabolita attivo ossipurinolo il febuxostat non è un analogo della purine, cosa che permette al farmaco di inibire soltanto la xantina ossidasi e non altri enzimi coinvolti nel metabolismo delle purine e delle pirimidine. L’assorbimento di febuxostat dopo somministrazione orale è molto rapido (circa l’ 85% si ritrova in circolo dopo 1 ora dall’assunzione) e non viene influenzato in modo significativo dall’assunzione di cibo e antiacidi. Il farmaco ha un’emivita di circa 12 ore, caratteristica questa che ne consente la monosomministrazione giornaliera. Pio III

Febuxostat viene principalmente metabolizzato a livello epatico mediante glucuronidazione e presenta una doppia via di eliminazione, epatica e renale. Ciò ne consente l’uso senza dover prevedere aggiustamenti posologici anche nei pazienti con insufficienza renale di grado moderato e negli anziani Febuxstat non presenta interazioni clinicamente rilevanti con il citocromo P 450 e quindi con i farmaci metabolizzati da questo sistema enzimatico. Come per l’allopurinolo anche per febuxostat va considerata la possibilità di una interazione con le 6 -mercaptopurina e l’azatioprina in ragione della metabolizzazione di questi farmaci attraverso la xantina ossidasi.

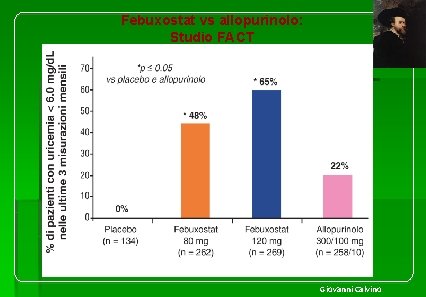
Febuxostat vs allopurinolo: Studio FACT Giovanni Calvino

Nei diversi studi clinici di confronto febuxostat ha sempre mostrato nei confronti di allopurinolo una maggiore efficacia nel ridurre i livelli di acido urico. Nel Febuxostat Allopurinol Controlled Trial (FACT) Study 762 pazienti con iperuricemia (≥ 8. 0 mg/d. L) cronica e deposito di cristalli di urato sono stati randomizzati a ricevere febuxostat (80 mg o 120 mg) oppure allopurinolo (300 mg) in monosomministrazione giornaliera per 52 settimane. L’endpoint primario era rappresentato dal conseguimento di una uricemia <6. 0 mg/d. L nelle ultime 3 misurazioni mensili. L’endpoint primario è stato raggiunto nel 53% dei pazienti trattati con febuxostat 80 mg, nel 62% di quelli trattati con febuxostat 120 mg e nel 21% dei pazienti randomizzati a ricevere allopurinolo 300 mg al giorno (p <0. 001 per entrambe le dosi di febuxostat versus allopurinolo) (Figura tratta da Becker MA, et al. New Engl J Med 2005; 353: 2450 -61). Analogamente, nello stesso studio la riduzione dell’area interessata da tofi risultava superiore nei pazienti trattati con febuxostat 80 mg (83%) e 120 mg (-66%) rispetto a quella osservata nei pazienti trattati con allopurinolo (-50%).

Febuxostat vs allopurinolo: Studio APEX

La manegevolezza di febuxostat anche nei pazienti con inziale danno renale ha trovato conferma nello Febuxostat, Allopurinol and Placebo -Controlled (APEX) Study nel quale 1. 072 pazienti con iperuricemia (≥ 8. 0 mg/d. L) cronica e deposito di cristalli di urato e creatininemia normale oppure moderatamente elevata (>1. 5 e ≤ 2. 0 mg/d. L) sono stati randomizzati al trattamento per 28 settimane con febuxostat (80 mg/die, 120 mg/die o 240 mg/die), allopurinolo (300 mg/die o 100 mg/die, in relazione alla funzione renale) o placebo. L’endpoint primario, rappresentato da una uricemia <6. 0 mg/d. L nelle ultime 3 misurazioni mensili, è stato osservato in una percentuale significativamente più elevata di pazienti assegnati al trattamento con febuxostat (80 mg = 48%; 120 mg = 65%; 240 mg = 69%) rispetto a quanto osservato nei pazienti assegnati ad allopurinolo (22%) o placebo (0%) (Figura tratta da Schumacher HR, et al. Arthritis Rheum. 2008; 59: 1540 -48).

La gotta è una condizione clinica che vede nel MMG il protagonista assoluto della sua gestione completa, dalla precisazione diagnostica, al trattamento degli attacchi acuti, alla prevenzione delle recidive gottose, prevendendo, ovviamente, la stretta collaborazione con lo specialista. La patologia è tipicamente cronica e richiede, quindi, un monitoraggio continuo al fine di controllare l’aderenza alla prescrizioni terapeutiche farmacologiche e non di cui la letteratura scientifica ha dimostrato chiaramente l’efficacia nel prevenire le riacutizzazioni. La crescente evidenza di una associazione sempre più solida tra iperuricemia, fattori di rischio cardiovascolare ed eventi cardiovascolari suggerisce l’opportunità di tenere sempre nella giusta considerazione i livelli di acido urico allorquando si approccia ad una strategia di prevenzione cardiovascolare. Stando a quanto suggerito dalle evidenze scientifiche parrebbe, infatti, alquanto miope limitare l’attenzione sul dismetabolismo dell’acido urico alla sola gotta.