Acadmie europenne des patients sur linnovation thrapeutique Autorisation




























- Slides: 29

Académie européenne des patients sur l’innovation thérapeutique Autorisation de mise sur le marché

Autorisation de mise sur le marché : principes de base (1) Académie européenne des patients sur l’innovation thérapeutique § Un produit pharmaceutique peut uniquement être mis sur le marché dans l’Espace économique européen (EEE) après avoir obtenu l’autorisation de mise sur le marché (AMM) auprès de l’autorité compétente d’un État membre (MS) ou auprès de la Commission européenne après évaluation scientifique par l’Agence européenne des médicaments (EMA). § Le procédé d’obtention de l’autorisation de mise sur le marché est très complexe et rigoureusement réglementé. 2

Autorisation de mise sur le marché : principes de base (2) Académie européenne des patients sur l’innovation thérapeutique § Le principe majeur derrière la législation pharmaceutique existante concerne la protection de la santé publique. § Les AMM de produits pharmaceutiques sont des documents dynamiques ; le dossier d’une AMM doit être régulièrement mis à jour afin de s’assurer du respect du progrès scientifique et des nouvelles exigences réglementaires. § Toute nouvelle information qui pourrait influencer l’évaluation des bénéfices et des risques liés à un produit pharmaceutique doit être rapidement transmise à l’autorité compétente. 3

Dossier de demande d’AMM et Document technique commun (CTD) Académie européenne des patients sur l’innovation thérapeutique § Le demandeur doit soumettre un dossier de demande d’AMM (DAMM) à l’autorité compétente qui doit prouver que le médicament offre la qualité requise, qu’il est sûr et qu’il est efficace. § Le dossier doit suivre le Document technique commun (CTD), un ensemble de spécifications pour le dossier de DAMM. Ce CTD offre un format harmonisé reconnu internationalement qui doit être suivi pour les demandes devant être présentées aux autorités réglementaires. 4

Document technique commun (CTD) Académie européenne des patients sur l’innovation thérapeutique § Le Document technique commun (CTD) : Ø Détermine un format adapté pour les données nécessaires à une demande Ø S’applique à tous les types de DAMM, quel que soit le type de procédure ou de demande Ø Comporte cinq modules - les modules 2 à 4 constituent le CTD lui-même, et le module 1 diffère selon l’endroit Ø Une directive e. CTD indique comment élaborer une version électronique du CTD 5

Document technique commun : modules (1) Académie européenne des patients sur l’innovation thérapeutique § 1. Informations régionales Ø Données administratives spécifiques, y compris le formulaire de demande Ø Plan de gestion des risques (PGR) Ø Résumé des caractéristiques du produit (RCP) Ø Étiquetage et notice § 2. Résumé global sur la qualité Ø Résumés/présentations non cliniques et résumés/présentations cliniques 6

Document technique commun : modules (2) Académie européenne des patients sur l’innovation thérapeutique § 3. Qualité Ø Informations chimiques, pharmaceutiques et/ou biologiques § 4. Non clinique Ø Rapports d’études non cliniques (pharmacologie/toxicologie) § 5. Clinique Ø Rapports d’études cliniques 7

Document technique commun : modules (3) Académie européenne des patients sur l’innovation thérapeutique ICH (2015). Le triangle du CTD. Consulté le 7 septembre 2015 sur http: //www. ich. org/products/ctd. html 8

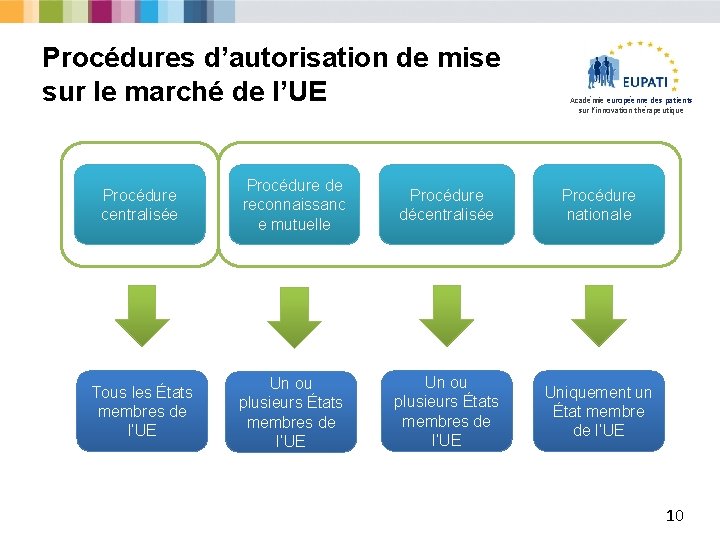
Exigences procédurales pour l’obtention de l’autorisation de mise sur le marché (AMM) Académie européenne des patients sur l’innovation thérapeutique § Une AMM peut s’obtenir de deux manières différentes : Ø Procédure centralisée (CP) Ø Procédures non centralisées - Procédure décentralisée (DCP) - Procédure de reconnaissance mutuelle (MRP) - Procédure nationale § Chaque procédure spécifie ses propres responsabilités et dispositions juridiques pour les autorités compétentes (EMA ou ANC, c’est-à-dire autorités nationales compétentes) et les titulaires d’AMM. 9

Procédures d’autorisation de mise sur le marché de l’UE Académie européenne des patients sur l’innovation thérapeutique Procédure centralisée Procédure de reconnaissanc e mutuelle Procédure z décentralisée Procédure nationale Tous les États membres de l’UE Un ou plusieurs États membres de l’UE Uniquement un État membre de l’UE 10

Procédure centralisée (CP) (1) Académie européenne des patients sur l’innovation thérapeutique § L’Agence européenne des médicaments (EMA) est responsable de la CP § Une seule demande est déposée auprès l’EMA ; tous les États membres (MS) sont impliqués dans la procédure § Le Comité des médicaments à usage humain (CHMP) procède à une évaluation scientifique du dossier § Des experts rapporteurs et co-rapporteurs de chaque MS (souvent de l’autorité réglementaire) évaluent le dossier § La procédure complète prend jusqu’à 210 jours, mais des « clock stops » sont possibles 11

Procédure centralisée (CP) (2) Académie européenne des patients sur l’innovation thérapeutique § Le CHMP fait finalement part de son opinion et recommande à la Commission européenne d’octroyer ou de ne pas octroyer l’AMM au médicament. § L’AMM est donc finalement accordée par la Commission européenne. § La CP résulte en une AMM pan-européenne, valide dans tous les États de l’Espace économique européen (EEE). Le même nom commercial (nom inventé) est employé dans tous les États, et les informations courantes sur le produit (résumé des caractéristiques du produit [RCP], étiquettes et notices) sont traduites dans les 24 langues officielles de l’UE. 12

Procédure centralisée (CP) (3) Académie européenne des patients sur l’innovation thérapeutique § La CP est obligatoire pour : Ø les médicaments traitant les pathologies suivantes ○ VIH ou SIDA ○ maladies neurodégénérative ○ cancer ○ troubles auto-immuns ou autres anomalies du système immunitaire ○ diabète ○ maladies virales Ø les médicaments dérivés des produits biotechnologiques (génie génétique par exemple) Ø les médicaments basés sur des thérapies avancées, telles que la thérapie génique, la thérapie cellulaire somatique ou les médicaments issus de l’ingénierie tissulaire Ø les médicaments orphelins (destinés aux maladies humaines rares) § La CP est facultative pour : Ø les médicaments qui constituent des innovations techniques, scientifiques ou thérapeutiques considérables Ø les médicaments dans l’intérêt de la santé publique 13

Procédures non centralisées Académie européenne des patients sur l’innovation thérapeutique § Il existe trois systèmes pour les nouvelles demandes qui ne peuvent pas suivre la CP ou choisissent de ne pas la suivre : Ø La procédure nationale Ø La procédure de reconnaissance mutuelle (MRP) d’un produit déjà autorisé (titulaire d’une AMM nationale) Ø La procédure décentralisée (lorsque le produit ne dispose pas d’AMM européenne existante) 14

Procédures nationales Académie européenne des patients sur l’innovation thérapeutique § Les procédures nationales peuvent être suivies dans deux circonstances : Ø Les procédures nationales indépendantes, strictement limitées aux médicaments qui doivent être autorisés et commercialisés dans un seul État membre - Si le médicament doit être commercialisé dans plusieurs États membres, la procédure nationale doit être suivie d’une procédure de reconnaissance mutuelle. Il est aussi possible de choisir une procédure décentralisée pour obtenir des AMM en parallèle dans plusieurs États membres. Ø Pour les extensions de médicaments déjà autorisés au niveau national - Dosages, formes pharmaceutiques ou voies d’administration supplémentaires 15

Procédures de reconnaissance mutuelle et décentralisées (1) Académie européenne des patients sur l’innovation thérapeutique § Les deux procédures sont basées sur la reconnaissance par des autorités nationales compétentes d’une évaluation effectuée par les autorités d’un État membre. § Ces procédures ont pour objectif de faciliter l’accès à un marché unique en comptant sur la reconnaissance mutuelle § Un État membre de référence (RMS) et un ou plusieurs États membres concernés (CMS) sont impliqués § Il n’est pas nécessaire de recher une AMM dans les 28 États membres pour utiliser ces procédures ; deux au minimum suffisent. 16

Procédures de reconnaissance mutuelle et décentralisées (2) Académie européenne des patients sur l’innovation thérapeutique § Le dossier de demande d’autorisation de mise sur le marché (DAMM) est évalué par un État membre (celui de référence, RMS) qui fait part de son analyse aux autres États membres (les États concernés, CMS) § La société peut choisir le RMS et les CMS § La société peut choisir le nom commercial § Une AMM nationale (y compris RCP et notice homogénéisés) est octroyée par chaque État membre impliqué § Ces procédures sont contrôlées par les chefs d’agences de médicaments (HMA) par le biais du groupe de coordination des procédures de reconnaissance mutuelle et décentralisées (CMDh) 17

Procédure de reconnaissance mutuelle (MRP) Académie européenne des patients sur l’innovation thérapeutique § Une demande identique de reconnaissance mutuelle doit être déposée auprès de tous les CMS § Le RMS prépare un rapport d’évaluation ou en actualise un existant dans les 90 jours § Des copies du rapport d’évaluation sont envoyées à tous les CMS avec le RCP, l’étiquetage et la notice approuvés § Les CMS ont alors 90 jours pour reconnaître la décision du RMS § Les AMM nationales seront octroyées dans les 30 jours suivant la reconnaissance de l’accord 18

Objections à la reconnaissance mutuelle Académie européenne des patients sur l’innovation thérapeutique § Les objections à la reconnaissance peuvent uniquement invoquer un risque grave potentiel pour la santé publique. * § Le problème sera alors déféré au groupe de coordination (CMDh) où les États membres devront parvenir à un consensus dans les 60 jours. En cas d’échec, la procédure est soumise à l’arbitration du comité scientifique (CHMP) de l’EMA. * En vertu de la directive 2001/83/CE, le terme « risque lié à l’usage d’un médicament » est défini en tant que « tout risque pour la santé du patient ou la santé publique lié à la qualité, à la sécurité ou à l’efficacité du médicament » (ou tout risque d’effets indésirables sur l’environnement). 19

Procédure décentralisée (DCP) Académie européenne des patients sur l’innovation thérapeutique § La DCP est disponible pour les nouveaux produits qui n’ont pas encore été autorisés dans un pays de l’EEE et pour lesquels la CP n’est pas obligatoire § La demande est déposée simultanément auprès de tous les États membres impliqués. Le RMS prépare un rapport d’évaluation. Les CMS ont alors 90 jours pour reconnaître la décision du RMS ou indiquer les problèmes à résoudre. § Les AMM nationales seront octroyées dans les 30 jours suivant la reconnaissance de l’accord § Le produit fait l’objet d’une autorisation nationale dans le RMS et dans chaque CMS avec un RCP, une notice et un étiquetage homogénéisés 20

Types de demandes pour l’AMM d’un produit pharmaceutique Académie européenne des patients sur l’innovation thérapeutique § Demande autonome (complète) (tous les modules du CTD) § Demande mixte § Demande générique § Demande hybride § Demande de produit biologique similaire (biosimilaire) § Demande d’usage bien établi § Demande de nouvelle combinaison contenant des principes actifs déjà utilisés dans des produits autorisés § Demande de « consentement éclairé » 21

Extension d’une AMM Académie européenne des patients sur l’innovation thérapeutique § « L’extension d’une AMM » ou « extension » indique une modification répertoriée à l’annexe I du règlement (CE) nº 1234/2008 et qui remplit les conditions ci-dessous : Ø 1. Modifications du ou des principes actifs lorsque les caractéristiques de sécurité et d’efficacité ne sont pas vraiment différentes Ø 2. Modifications du dosage, de la forme pharmaceutique ou de la voie d’administration § De telles demandes sont évaluées conformément à la même procédure que celle prévue pour les AMM initiales § L’extension peut être octroyée en tant que nouvelle AMM ou incluse dans l’AMM initiale à laquelle se rapporte 22

Procédures de variation (1) Académie européenne des patients sur l’innovation thérapeutique § Article 23 de la directive 2001/83/CE § Exige que le titulaire de l’AMM actualise le dossier en permanence afin de tenir compte des progrès techniques et scientifiques, et qu’il introduise toute modification qui peut s’avérer nécessaire pour la fabrication et le contrôle du produit pharmaceutique § L’actualisation doit passer la procédure de variations et figurer dans le dossier et/ou dans les présentations et résumés globaux, le cas échéant 23

Procédures de variation (2) Académie européenne des patients sur l’innovation thérapeutique § Chaque titulaire d’autorisation de mise sur le marché (TAMM) doit actualiser l’AMM avec l’apparition de nouvelles données pendant toute la durée de vie du produit. Il convient d’utiliser alors la procédure de variation. § Toute demande par le TAMM de modification de la longueur d’une AMM octroyée conformément à la législation doit être déposée auprès de tous les États membres ayant précédemment autorisé le produit pharmaceutique en question. 24

Renouvellements Académie européenne des patients sur l’innovation thérapeutique § L’AMM peut être renouvelée après cinq ans sur la base d’une réévaluation du rapport bénéfices/risques par l’autorité compétente de l’État membre responsable. § Au moins 9 mois avant l’expiration de l’AMM, le TAMM fournit à l’autorité compétente une version consolidée du fichier en matière de qualité, de sécurité et d’efficacité, y compris toutes les variations introduites depuis l’obtention de l’AMM. § Une fois renouvelée, l’AMM est valide pour une période illimitée, sauf si l’autorité compétente décide sur la base d’arguments de pharmacovigilance justifiés de procéder à un renouvellement supplémentaire de cinq ans. 25

Refus d’une AMM Académie européenne des patients sur l’innovation thérapeutique § L’AMM sera refusée si Ø Le rapport bénéfices/risques est considéré comme non favorable Ø L’efficacité thérapeutique est insuffisamment justifiée par le demandeur Ø La composition qualitative ou quantitative n’est pas déclarée § L’AMM sera également refusée si des documents ou des informations envoyés avec la demande ne sont pas conformes à la législation. § Le demandeur ou TAMM est responsable de l’exactitude des données et documents fournis 26

Options d’obtention d’une AMM Académie européenne des patients sur l’innovation thérapeutique § Selon la demande, les différentes options sont : § Pour les CP Ø Autorisation de mise sur le marché conditionnelle Ø Autorisation de mise sur le marché octroyée dans des circonstances exceptionnelles § Pour les procédures nationales/DCP/MRP Ø Autorisation de mise sur le marché octroyée dans des circonstances exceptionnelles 27

Lectures complémentaires Académie européenne des patients sur l’innovation thérapeutique § Base légale – Législation européenne – EUDRALEX § La législation de l’industrie pharmaceutique peut se trouver dans divers volumes de la publication The rules governing medicinal products in the EU. Disponible sur http: //ec. europa. eu/health/documents/eudralex/index_en. htm (consulté le 8 septembre 2015). 28

Lectures complémentaires Académie européenne des patients sur l’innovation thérapeutique § Volume 1 – Pharmaceutical legislation of EUDRALEX contient des directives, des règlements et d’autres informations. Il y a deux textes fondamentaux : § Parlement européen (2001). Directive 2001/83/CE sur le code communautaire relatif aux médicaments à usage humain. Consultée le 8 septembre 2015 sur http: //eur-lex. europa. eu/legalcontent/EN/TXT/? qid=1441700788112&uri=CELEX: 32001 L 0083 § Parlement européen (2004). Règlement (CE) nº 726/2004/CE spécifiant les procédures communautaires relatives à l’autorisation et à la supervision des médicaments à usage humain et vétérinaires, et établissant une Agence européenne des médicaments. Consulté le 8 septembre 2015 sur http: //eur-lex. europa. eu/legalcontent/EN/TXT/? qid=1441697290872&uri=CELEX: 32004 R 0726 29
 Turquie union europenne
Turquie union europenne Autorisation maritale
Autorisation maritale Lunion europenne
Lunion europenne Autorisation restaurant
Autorisation restaurant Autorisation ntfs
Autorisation ntfs Des des des
Des des des Gestion axée sur les résultats
Gestion axée sur les résultats Allez vous en sur les places paroles
Allez vous en sur les places paroles Introduction sur la gestion des stocks
Introduction sur la gestion des stocks Elle met des cerises sur son chapeau la vieille
Elle met des cerises sur son chapeau la vieille Vendre ses photos sur internet
Vendre ses photos sur internet Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Des phrases et des bases affiche soviétique 1952
Des phrases et des bases affiche soviétique 1952 Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs La diffusion des idées des lumières
La diffusion des idées des lumières Mesure de volume des liquides et des corps solides
Mesure de volume des liquides et des corps solides Robin des bois des alpes
Robin des bois des alpes Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Mesure des liquides
Mesure des liquides Triple des meet in the middle attack
Triple des meet in the middle attack Les temps verbaux et leurs valeurs
Les temps verbaux et leurs valeurs Cartographie des flux
Cartographie des flux Pico questions
Pico questions Non-infective
Non-infective Dr carlson advises his depressed patients
Dr carlson advises his depressed patients Preoperative nursing care for eye surgery
Preoperative nursing care for eye surgery Medicare improvements for patients and providers act
Medicare improvements for patients and providers act What are the 7 patient rights?
What are the 7 patient rights? Dealing with challenging patients
Dealing with challenging patients





















































