A VI fcsoport elemei s vegyleteik oxign kn









- Slides: 10

A VI. főcsoport elemei és vegyületeik oxigén kén (S) Szelén (Se) Tellúr (Te) (kalkogének – kőképzők)

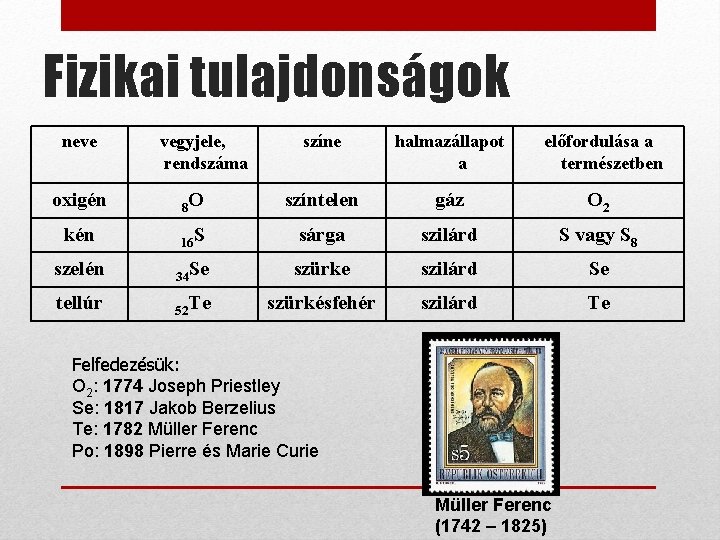
Fizikai tulajdonságok neve vegyjele, rendszáma színe halmazállapot a előfordulása a természetben oxigén 8 O színtelen gáz O 2 kén 16 S sárga szilárd S vagy S 8 szelén 34 Se szürke szilárd Se tellúr 52 Te szürkésfehér szilárd Te Felfedezésük: O 2: 1774 Joseph Priestley Se: 1817 Jakob Berzelius Te: 1782 Müller Ferenc Po: 1898 Pierre és Marie Curie Müller Ferenc (1742 – 1825)

Fizikai tulajdonságok (oxigén) • Az oxigén a periódusos rendszer VI. a csoportjába tartozó nemfémes kémiai elem; • paramágneses tulajdonságú. • Szobahőmérsékleten gáz halmazállapotú • Cseppfolyós halmazállapotban világoskék színű, sűrűsége a víznél nagyobb (1, 118 g/cm 3), • szilárd halmazállapotban sötétebb kék kristályokká alakul. • Vízben kis mértékben oldódik (1 liter vízben 31 cm 3, ez a vízi élővilág szempontjából rendkívül fontos). • Az olvadt ezüst saját térfogatának több mint húszszorosát képes oxigénből feloldani. Színe Színtelen Szaga Szagtalan Halmazállapota Gáz Olvadáspontja -218, 8 o. C Forráspontja -183, 0 o. C Sűrűsége 1, 31 g/cm 3 Sűrűsége a levegőhöz viszonyítva 1, 1 -szer nagyobb

Kémiai tulajdonságok • • O O 4 e- O Képlete: O 2 Moláris tömege: 32 g/mol 6 vegyértékelektronja van Szobahőmérsékleten csak kevéssé aktív, magasabb hőmérsékleten vagy atomos állapotban ("aktív oxigén") azonban igen reakcióképes. • A legkisebb elektronegativitású fémekkel főleg ionos kötéseket létesít. A nagy elektronegativitású nemfémekkel kovalens kötésű, molekularácsos vegyületeket képez. • Az oxigén a legelterjedtebb elem a Földön. • Oxigénben az anyagok hevesebben égnek, az égést táplálja. • Legjelentősebb allotróp módosulata az ózon (O 3)

Előállítása Laboratóriumban Általában oxigéntartalmú vegyületek (pl. Hg. O, KMn. O 4, KCl. O 3, KCl. O 4 ) termikus(hő) bontásával nyernek oxigént. Gyengén savanyított vagy lúgosított víz elektrolízisével (az oxigén az anódon fejlődik) is elő állítják. Iparilag Az oxigént legnagyobb mennyiségben cseppfolyósított levegő frakcinált desztillációjával állítják elő (előbb a nitrogén távozik, míg a visszamaradó rész oxigénben feldúsul). Előállítható még hidrogén-peroxid spontán vagy katalitikus bontásával illetve oxidálásával. 15 MPa nyomáson, kék csíkkal megjelölt acélpalackokban hozzák forgalomba.

Kémiai reakciói • Legfontosabb reakciói az égések, vagyis az oxigénnel való egyesülések • Fémekkel • Nemfémes elemekkel • Vegyületekkel

Felhasználása • Gyógyászatban légzési elégtelenségnél. • Iparban magas hőmérsékletű lángok előállításához. • Kötött formában tisztítószerekhez.

Előfordulása • Természetben elemi állapotban és vegyületeiben egyaránt. Kőzetek tömegének felét adja. • A növények fotoszintézisük során vízből állítják elő. • A levegő 21%-át alkotja. Mennyisége állandó, de kismértékű változása is nagy változásokat idéz elő az élővilágban.

Oxigén fontosabb vegyületei Víz (H 2 O) • Erős hidrogénkötés, vízben legstabilabbak a négyes asszociátumok (H 8 O 4) • Jég: folyadéknál lazább szerkezete miatt sűrűsége kisebb mint a vízé (térfogata nagyobb 9%-al). Víz sűrűsége is +4 ºC-on a legnagyobb. Hidrogén-peroxid (H 2 O 2) • Színtelen, szagtalan, nem éghető folyadék • Erős hidrogénkötést képez, vízzel korlátlanul elegyedik • Peroxokötés gyenge, erősen bomlékony: H 2 O 2 = H 2 O + O A felszabaduló naszcensz (atomos) oxigén miatt erős oxidálószer. Fontosabb alkalmazásai: fertőtlenítőszer, színtelenítőszer, rakéták üzemanyaga Bomlását nehézfémek és sóik katalizálják

Érdekességek • Ecetesedés = alkoholok levegővel való érintkezése során bekövetkező oxidációja ecetsavvá • avasodás = zsírok, olajok, vajak oxidációja • az oxigént 1733 -ban a svéd Scheele, majd később, 1774 ben az angol Priestley fedezte fel. Priestley előbb hozta nyilvánosságra kutatásainak eredményeit, ezért őt tartják az oxigén felfedezőjének