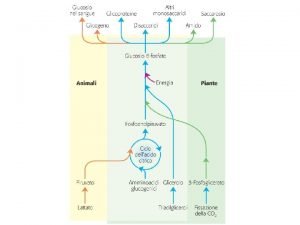
a Reazioni che non comportano variazione del numero



















- Slides: 20




a) Reazioni che non comportano variazione del numero di ossidazione degli atomi di sostanze che partecipano alla reazione (nessun trasferimento di e-): reazioni acido-base e reazioni di scambio. b) Reazioni che comportano variazione del numero di ossidazione di alcuni atomi di sostanze che partecipano alla reazione (trasferimento di e-): reazioni di ossido-riduzione o reazioni redox.

Reazioni acido-base (reazioni di salificazione) Reazioni fra una sostanza a carattere acido (ossoacidi, idracidi, ossidi acidi) e una sostanza a carattere basico (idrossidi, ossidi basici, basi protoniche) con formazione di sali. • HNO 3 + Na. OH = Na. NO 3 + H 2 O • 2 HCl + Ca. O = Ca. Cl 2 + H 2 O • SO 3 + Ba. O = Ba. SO 4 • CO 2 + Ca(OH)2 = Ca. CO 3 + H 2 O • H 2 SO 4 + 2 NH 3 = (NH 4)2 SO 4 Base protonica

La maggior parte di reazioni in soluzione acquosa avvengono tra elettroliti cioè sostanze che si dissociano in ioni. Si dissociano: • Acidi • Basi • Sali

…. . in realtà: HNO 3(aq) + Na. OH(aq) = Na. NO 3(aq) + H 2 O(l) H+(aq) + NO 3 -(aq) + Na+(aq) + OH-(aq) = Na+(aq) + NO 3 -(aq) + H 2 O ioni spettatori Equazione ionica netta: H+ + OH- = H 2 O (neutralizzazione)

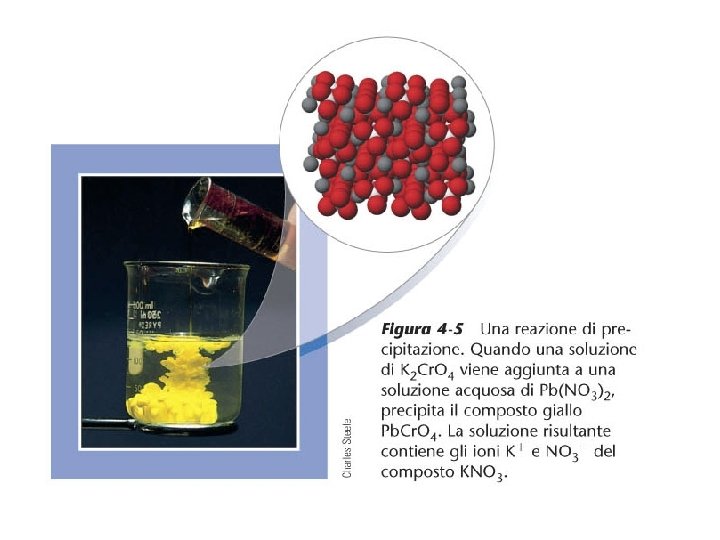
Reazioni di scambio Tali reazioni comportano lo scambio di porzioni (cationi o anioni) delle sostanze reagenti Fe. S(s) + 2 HCl(aq) = Fe. Cl 2 + H 2 S(g) Na 2 CO 3(aq) + Ca(OH)2(aq) = Ca. CO 3(s) + 2 Na. OH(aq) (precipitazione) 2 KI(aq) + Pb(NO 3)2(aq) = 2 KNO 3(aq) + Pb. I 2(s) Ca. CO 3(s) + 2 CH 3 COOH(aq) = Ca(CH 3 COO)2(aq) + H 2 CO 3(aq) = H 2 O(l) + CO 2(g)


Reazione di precipitazione.

Reazioni in cui alcuni atomi variano il loro numero di ossidazione: si ha trasferimento di e- tra le specie coinvolte. Se vi è una sostanza contenente un elemento che aumenta il proprio n. o. , deve necessariamente essere presente un’altra sostanza che contiene un elemento che diminuisce il proprio n. o. Ossidazione: una specie chimica perde elettroni n. o. aumenta Riduzione: una specie chimica acquista elettroni n. o. diminuisce Riducente: specie che aumenta il proprio n. o. (si ossida perde e-) Ossidante: specie che riduce il proprio n. o. (si riduce acquista e-) CH 4(g) + 2 O 2(g) = CO 2(g) + 2 H 2 O(g) (reazione di combustione) 3 H 2(g) + N 2(g) = 2 NH 3(g) (sintesi dell’ammoniaca) Cu(s) + 2 Ag. NO 3(aq) = 2 Ag(s) + Cu(NO 3)2 (aq) (reazione di spostamento)




K 2 Cr 2 O 7(aq) + 6 Fe. SO 4(aq) + 7 H 2 SO 4(aq) = Cr 2(SO 4)3(aq) + 3 Fe 2(SO 4)3 (aq) + K 2 SO 4 (aq) + 7 H 2 O(l)

Bi 2 O 3 (s) + 2 Na. Cl. O(aq) + 2 Na. OH(aq) = 2 Na. Bi. O 3(aq) + 2 Na. Cl(aq) + H 2 O(l)


Reazioni di disproporzionamento o dismutazione Una sola specie chimica agisce sia da ossidante che da riducente Cl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O 3 NO 2 + H 2 O = 2 HNO 3 + NO


 Variazione numeraria attiva
Variazione numeraria attiva Elo rating fide
Elo rating fide Variazione magnetica topografia
Variazione magnetica topografia Dlgs 127/91
Dlgs 127/91 La vita che avrai non sarà mai distante dall'amore che dai
La vita che avrai non sarà mai distante dall'amore che dai Non fare mai agli altri quello che non vorresti
Non fare mai agli altri quello che non vorresti Glicolisi reazioni
Glicolisi reazioni Reazioni ossido riduzione
Reazioni ossido riduzione Bilanciamento reazioni redox
Bilanciamento reazioni redox Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Dissociazione chimica
Dissociazione chimica In una reazione di ossidoriduzione
In una reazione di ossidoriduzione Reazioni chimiche esempi
Reazioni chimiche esempi Reazioni chimiche esempi
Reazioni chimiche esempi Molarità
Molarità Reazioni chimiche esempi
Reazioni chimiche esempi Idrossidi esempi
Idrossidi esempi Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Cinetica ordine zero
Cinetica ordine zero Mappe concettuali reazioni chimiche
Mappe concettuali reazioni chimiche Reazioni avverse
Reazioni avverse