A mhnyakrk elleni vdolts hatkonysga s az eddig


























- Slides: 55

A méhnyakrák elleni védőoltás hatékonysága és az eddig megszerzett tapasztalatok Prof. Bánhidy Ferenc Az előadás a Glaxo. Smith. Kline Kft. felkérésére készült.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Miről fogok ma beszélni? /mai program/ • Mik a Cervarix™ -al végzett klinikai vizsgálatok tapasztalatai ? • immunogenitás, hosszú távú védettségi adatok • hatékonyság • biztonságossági profil • Mik a széléskörű alkalmazás eddigi tapasztalatai ? • Milyen szempontokat vegyünk figyelembe a vakcinációs program elindításakor ?

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Today’s agenda • Mik a Cervarix™ -al végzett klinikai vizsgálatok tapasztalatai ? • immunogenicity, long-term protection data • overall efficacy • safety profile • Mik a széléskörű alkalmazás eddigi tapasztalatai ? • Milyen szempontokat vegyünk figyelembe a vakcinációs program elindításakor ?

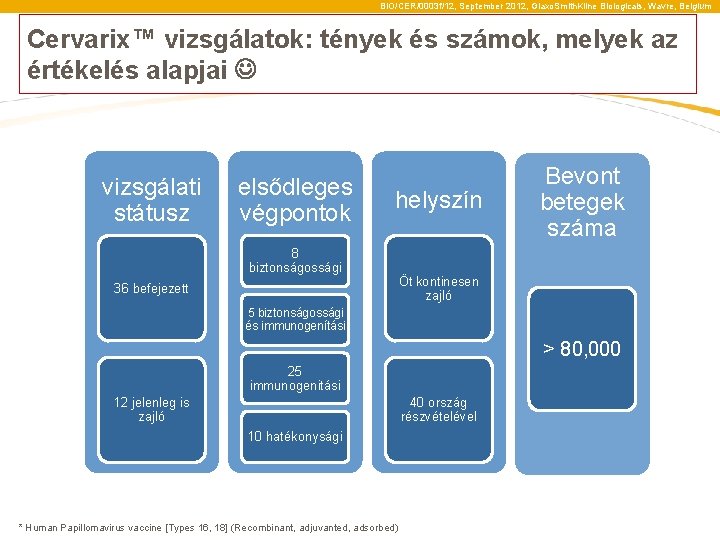
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix™ vizsgálatok: tények és számok, melyek az értékelés alapjai vizsgálati elsődleges végpontok státusz helyszín 8 biztonságossági 36 befejezett Bevont betegek száma Öt kontinesen zajló 5 biztonságossági és immunogenítási > 80, 000 25 immunogenitási 12 jelenleg is zajló 40 ország részvételével 10 hatékonysági * Human Papillomavirus vaccine [Types 16, 18] (Recombinant, adjuvanted, adsorbed)

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix™ trials: facts and figures to the evolution of the evidence Trial status Primary endpoints Location 8 safety Subjects Spanning 5 continents 36 completed 5 safety and immunogenicity > 80, 000 25 immunogenicity 12 ongoing 10 efficacy Representing > 40 countries * Human Papillomavirus vaccine [Types 16, 18] (Recombinant, adjuvanted, adsorbed)

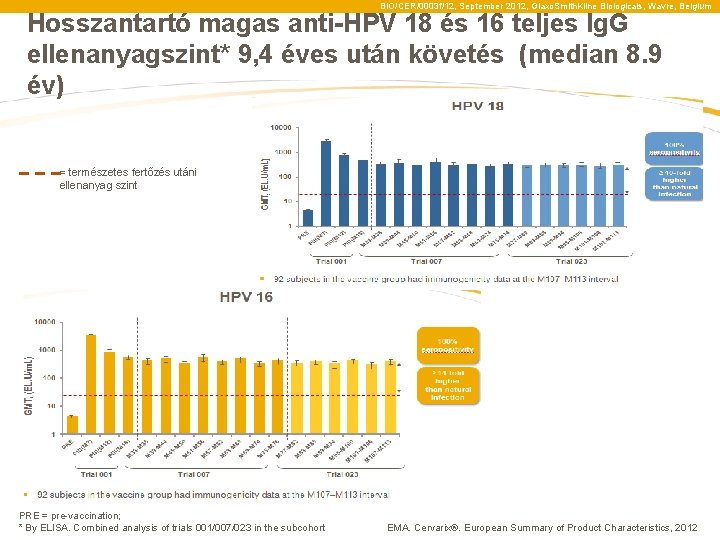
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Hosszantartó magas anti-HPV 18 és 16 teljes Ig. G ellenanyagszint* 9, 4 éves után követés (median 8. 9 év) = természetes fertőzés utáni ellenanyag szint PRE = pre-vaccination; * By ELISA. Combined analysis of trials 001/007/023 in the subcohort EMA. Cervarix®. European Summary of Product Characteristics, 2012

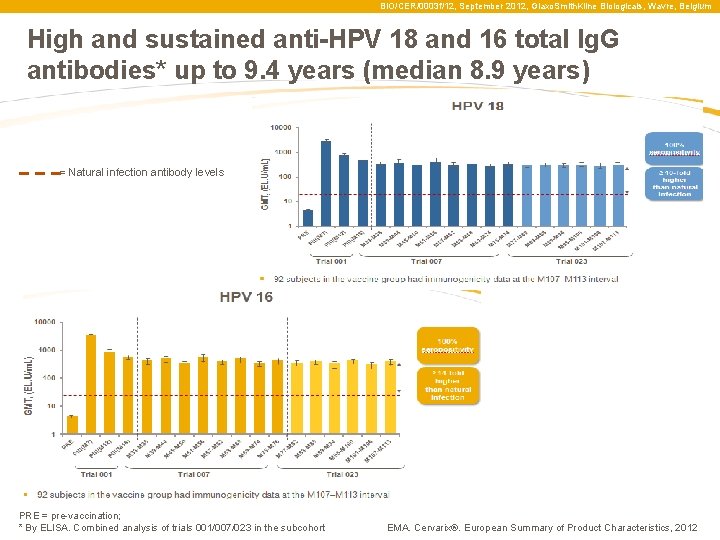
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium High and sustained anti-HPV 18 and 16 total Ig. G antibodies* up to 9. 4 years (median 8. 9 years) = Natural infection antibody levels PRE = pre-vaccination; * By ELISA. Combined analysis of trials 001/007/023 in the subcohort EMA. Cervarix®. European Summary of Product Characteristics, 2012

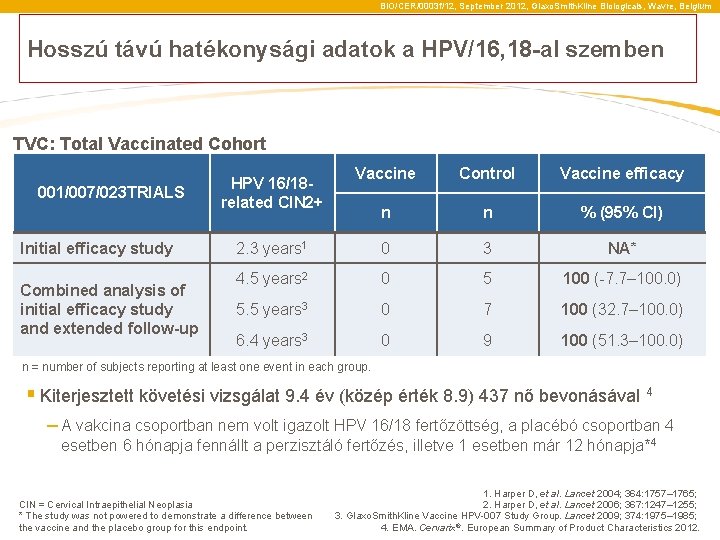
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Hosszú távú hatékonysági adatok a HPV/16, 18 -al szemben TVC: Total Vaccinated Cohort 001/007/023 TRIALS Initial efficacy study Combined analysis of initial efficacy study and extended follow-up Vaccine Control Vaccine efficacy n n % (95% CI) 2. 3 years 1 0 3 NA* 4. 5 years 2 0 5 100 (-7. 7– 100. 0) 5. 5 years 3 0 7 100 (32. 7– 100. 0) 6. 4 years 3 0 9 100 (51. 3– 100. 0) HPV 16/18 related CIN 2+ n = number of subjects reporting at least one event in each group. § Kiterjesztett követési vizsgálat 9. 4 év (közép érték 8. 9) 437 nő bevonásával 4 – A vakcina csoportban nem volt igazolt HPV 16/18 fertőzöttség, a placébó csoportban 4 esetben 6 hónapja fennállt a perzisztáló fertőzés, illetve 1 esetben már 12 hónapja*4 CIN = Cervical Intraepithelial Neoplasia * The study was not powered to demonstrate a difference between the vaccine and the placebo group for this endpoint. 1. Harper D, et al. Lancet 2004; 364: 1757– 1765; 2. Harper D, et al. Lancet 2006; 367: 1247– 1255; 3. Glaxo. Smith. Kline Vaccine HPV-007 Study Group. Lancet 2009; 374: 1975– 1985; 4. EMA. Cervarix®. European Summary of Product Characteristics 2012.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Long term efficacy data against HPV 16/18 TVC: Total Vaccinated Cohort 001/007/023 TRIALS Initial efficacy study Combined analysis of initial efficacy study and extended follow-up Vaccine Control Vaccine efficacy n n % (95% CI) 2. 3 years 1 0 3 NA* 4. 5 years 2 0 5 100 (-7. 7– 100. 0) 5. 5 years 3 0 7 100 (32. 7– 100. 0) 6. 4 years 3 0 9 100 (51. 3– 100. 0) HPV 16/18 related CIN 2+ n = number of subjects reporting at least one event in each group. § Extended follow-up to 9. 4 years (mean 8. 9) in a subcohort of 437 women 4 – No cases of infection or histopathological lesions associated with HPV 16 or HPV 18 in the vaccine group while in the placebo group, there were 4 cases of 6 -month persistent infection and 1 case of 12 -month persistent infection*4 CIN = Cervical Intraepithelial Neoplasia * The study was not powered to demonstrate a difference between the vaccine and the placebo group for this endpoint. 1. Harper D, et al. Lancet 2004; 364: 1757– 1765; 2. Harper D, et al. Lancet 2006; 367: 1247– 1255; 3. Glaxo. Smith. Kline Vaccine HPV-007 Study Group. Lancet 2009; 374: 1975– 1985; 4. EMA. Cervarix®. European Summary of Product Characteristics 2012.

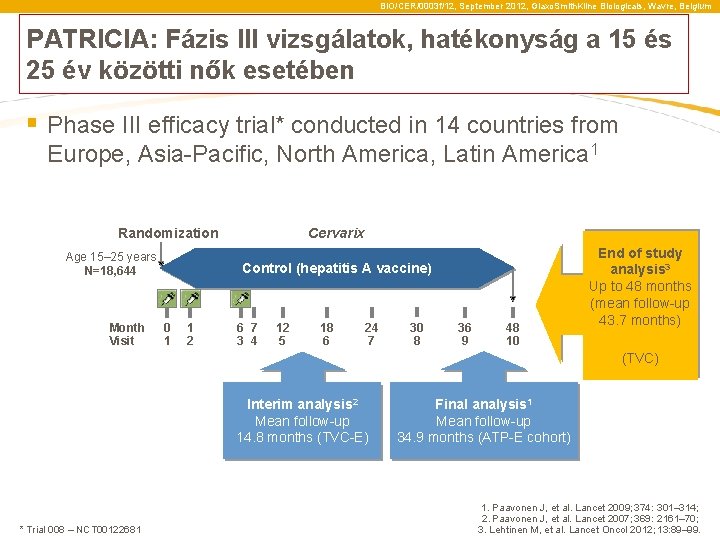
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Fázis III vizsgálatok, hatékonyság a 15 és 25 év közötti nők esetében § Phase III efficacy trial* conducted in 14 countries from Europe, Asia-Pacific, North America, Latin America 1 Randomization Age 15– 25 years N=18, 644 Month Visit Cervarix Control (hepatitis A vaccine) 0 1 1 2 6 7 3 4 12 5 18 6 24 7 30 8 36 9 48 10 End of study analysis 3 Up to 48 months (mean follow-up 43. 7 months) (TVC) Interim analysis 2 Mean follow-up 14. 8 months (TVC-E) * Trial 008 – NCT 00122681 Final analysis 1 Mean follow-up 34. 9 months (ATP-E cohort) 1. Paavonen J, et al. Lancet 2009; 374: 301– 314; 2. Paavonen J, et al. Lancet 2007; 369: 2161– 70; 3. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

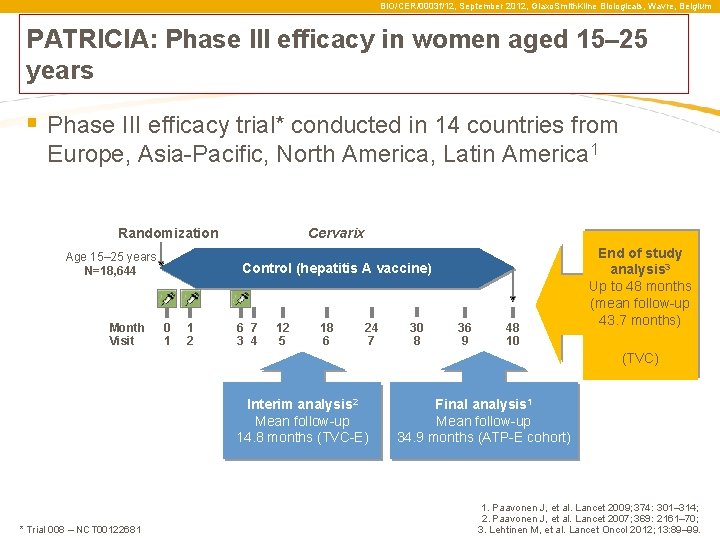
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Phase III efficacy in women aged 15– 25 years § Phase III efficacy trial* conducted in 14 countries from Europe, Asia-Pacific, North America, Latin America 1 Randomization Age 15– 25 years N=18, 644 Month Visit Cervarix Control (hepatitis A vaccine) 0 1 1 2 6 7 3 4 12 5 18 6 24 7 30 8 36 9 48 10 End of study analysis 3 Up to 48 months (mean follow-up 43. 7 months) (TVC) Interim analysis 2 Mean follow-up 14. 8 months (TVC-E) * Trial 008 – NCT 00122681 Final analysis 1 Mean follow-up 34. 9 months (ATP-E cohort) 1. Paavonen J, et al. Lancet 2009; 374: 301– 314; 2. Paavonen J, et al. Lancet 2007; 369: 2161– 70; 3. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

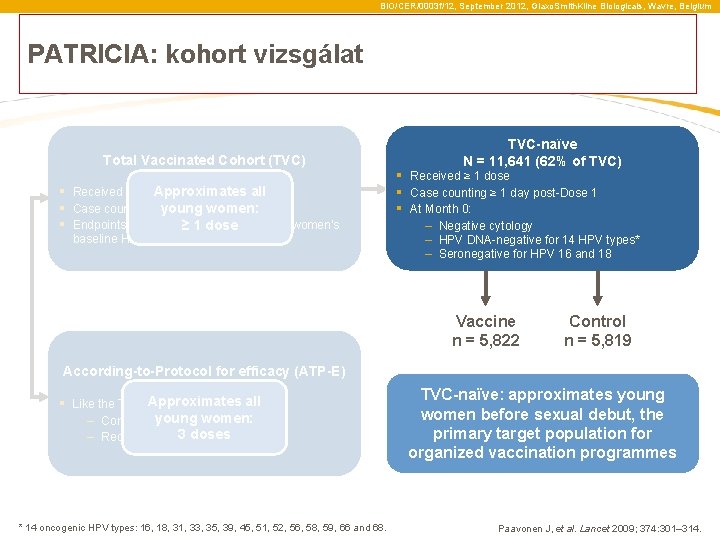
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: kohort vizsgálat Total Vaccinated Cohort (TVC) N = 18, 644 Approximates all § Received ≥ 1 dose § Case counting ≥ 1 day post-Dose 1 young women: § Endpoints were evaluated irrespective of women’s ≥ 1 dose baseline HPV DNA or serostatus TVC-naïve N = 11, 641 (62% of TVC) § Received ≥ 1 dose § Case counting ≥ 1 day post-Dose 1 § At Month 0: – Negative cytology – HPV DNA-negative for 14 HPV types* – Seronegative for HPV 16 and 18 Vaccine n = 5, 822 According-to-Protocol for efficacy (ATP-E) N = 16, 162 (87% of TVC) Approximates all § Like the TVC but: young women: – Complied with protocol 3 doses – Received 3 doses * 14 oncogenic HPV types: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 and 68. Control n = 5, 819 TVC-naïve: approximates young women before sexual debut, the primary target population for organized vaccination programmes Paavonen J, et al. Lancet 2009; 374: 301– 314.

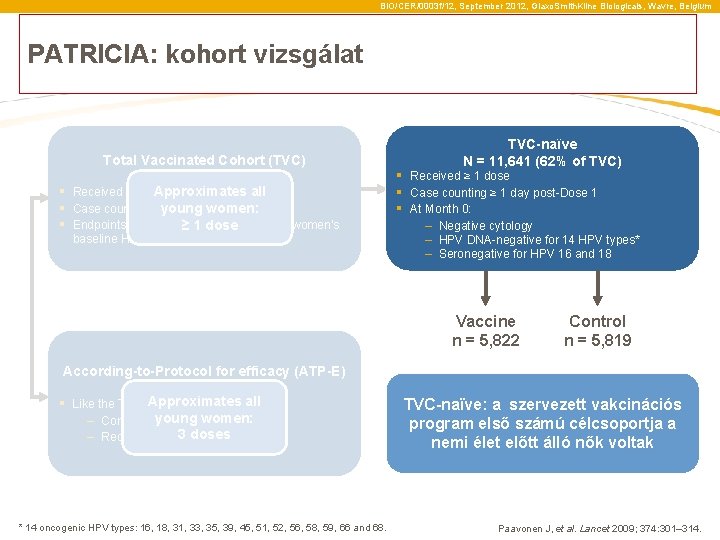
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: kohort vizsgálat Total Vaccinated Cohort (TVC) N = 18, 644 Approximates all § Received ≥ 1 dose § Case counting ≥ 1 day post-Dose 1 young women: § Endpoints were evaluated irrespective of women’s ≥ 1 dose baseline HPV DNA or serostatus TVC-naïve N = 11, 641 (62% of TVC) § Received ≥ 1 dose § Case counting ≥ 1 day post-Dose 1 § At Month 0: – Negative cytology – HPV DNA-negative for 14 HPV types* – Seronegative for HPV 16 and 18 Vaccine n = 5, 822 According-to-Protocol for efficacy (ATP-E) N = 16, 162 (87% of TVC) Approximates all § Like the TVC but: young women: – Complied with protocol 3 doses – Received 3 doses * 14 oncogenic HPV types: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 and 68. Control n = 5, 819 TVC-naïve: a szervezett vakcinációs program első számú célcsoportja a nemi élet előtt álló nők voltak Paavonen J, et al. Lancet 2009; 374: 301– 314.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium CIN 3 állapot, mint a méhnyak rákot kiváltó végpont § CIN 2 egy elfogadott, végpont a méhnyak rák helyett 1 • lényegét tekintve ez egy heterogén mikroszkópikus diagnózis, a biológia jelentésére pedig ez még inkább igaz 5 • Számos nem onkogén HPV törzs által okozott folyamat szintén CIN 2 lézióként kerülhet diagnosztizálásra 5 § A CIN 3 egy sokkal specifikusabb és szigorúbb végpont – jobban elkülöníthető egy friss HPV fertőzéstől 2 – jobban reprodukálható diagnosztikus végpont, mint a CIN 23, 4 – lényegesen gyakrabban alakul át méhnyak rákká 4 1. Castle PE et al. Am J Epidemiol 2010; 171: 155– 63; 2. Moscicki A et al. Vaccine 2006; 24(Suppl 3): 42 -51; 3. Carreon JD et al. Int J Gynecol Pathol 2007; 26: 441– 446; 4. Lehtinen M et al. Lancet Oncol 2012; 13: 89 -99 5. Schiffman, Kjaer. JNCI Monographs 2003 , No. 31; .

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium CIN 3 as a surrogate endpoint for cervical cancer § CIN 2 is considered an acceptable surrogate endpoint for cervical cancer 1 • There is substantial heterogeneity in the microscopic diagnosis and biologic meaning of CIN 2 lesions in particular. 5 • Some non-oncogenic HPV infections are capable of producing lesions diagnosed as CIN 2. 5 § CIN 3 is a more specific and more stringent endpoint – it can be reliably distinguished from a recently acquired HPV infection 2 – it is a more reproducible diagnostic endpoint than CIN 23, 4 – it more frequently progresses to invasive cervical carcinoma 4 1. Castle PE et al. Am J Epidemiol 2010; 171: 155– 63; 2. Moscicki A et al. Vaccine 2006; 24(Suppl 3): 42 -51; 3. Carreon JD et al. Int J Gynecol Pathol 2007; 26: 441– 446; 4. Lehtinen M et al. Lancet Oncol 2012; 13: 89 -99 5. Schiffman, Kjaer. JNCI Monographs 2003 , No. 31; .

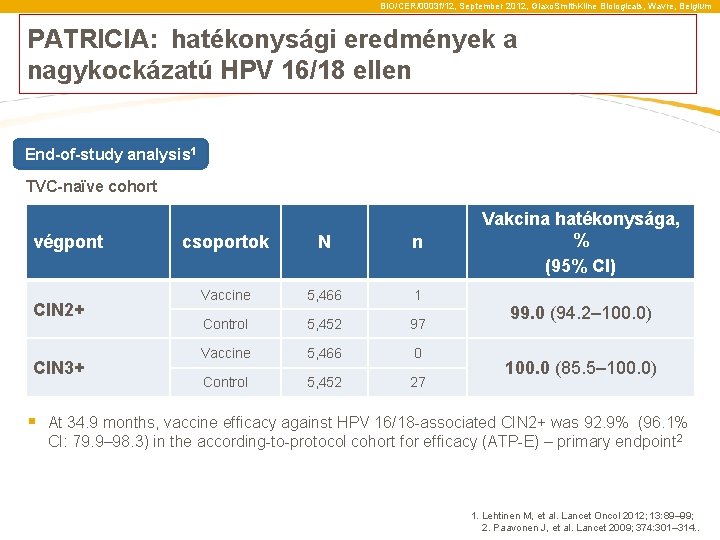
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: hatékonysági eredmények a nagykockázatú HPV 16/18 ellen End-of-study analysis 1 TVC-naïve cohort végpont CIN 2+ CIN 3+ csoportok N n Vaccine 5, 466 1 Control 5, 452 97 Vaccine 5, 466 0 Control 5, 452 27 Vakcina hatékonysága, % (95% CI) 99. 0 (94. 2– 100. 0) 100. 0 (85. 5– 100. 0) § At 34. 9 months, vaccine efficacy against HPV 16/18 -associated CIN 2+ was 92. 9% (96. 1% CI: 79. 9– 98. 3) in the according-to-protocol cohort for efficacy (ATP-E) – primary endpoint 2 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99; 2. Paavonen J, et al. Lancet 2009; 374: 301– 314. .

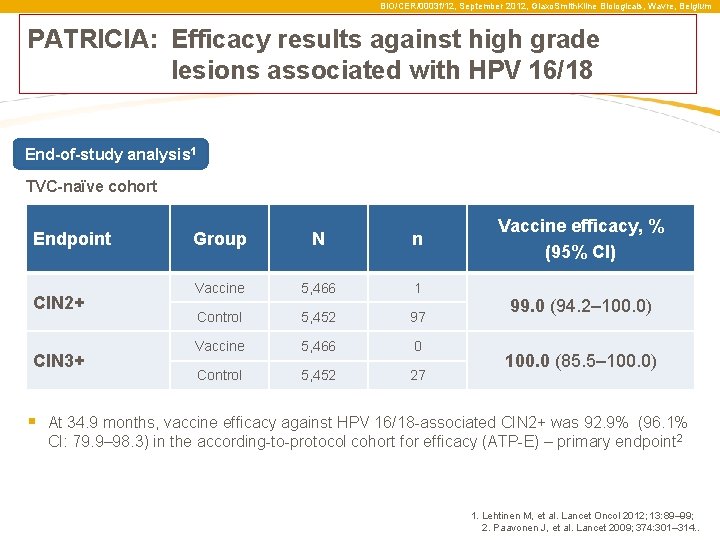
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Efficacy results against high grade lesions associated with HPV 16/18 End-of-study analysis 1 TVC-naïve cohort Endpoint CIN 2+ CIN 3+ Group N n Vaccine 5, 466 1 Control 5, 452 97 Vaccine 5, 466 0 Control 5, 452 27 Vaccine efficacy, % (95% CI) 99. 0 (94. 2– 100. 0) 100. 0 (85. 5– 100. 0) § At 34. 9 months, vaccine efficacy against HPV 16/18 -associated CIN 2+ was 92. 9% (96. 1% CI: 79. 9– 98. 3) in the according-to-protocol cohort for efficacy (ATP-E) – primary endpoint 2 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99; 2. Paavonen J, et al. Lancet 2009; 374: 301– 314. .

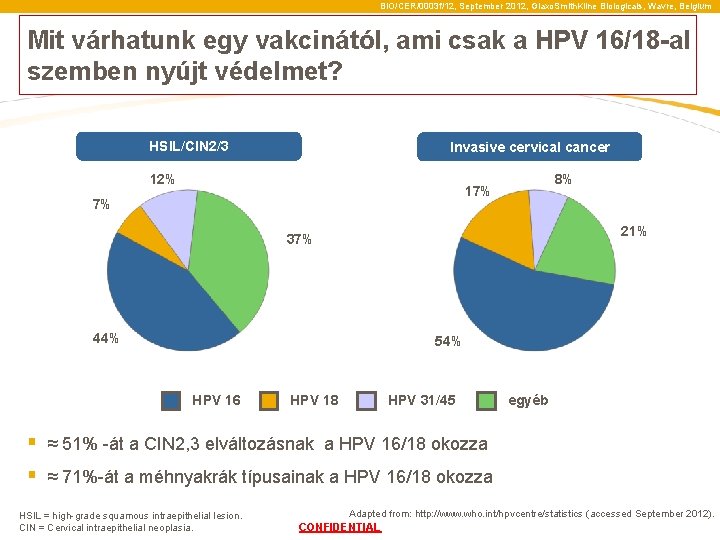
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Mit várhatunk egy vakcinától, ami csak a HPV 16/18 -al szemben nyújt védelmet? HSIL/CIN 2/3 Invasive cervical cancer 12% 8% 17% 7% 21% 37% 44% 54% HPV 16 HPV 18 HPV 31/45 egyéb § ≈ 51% -át a CIN 2, 3 elváltozásnak a HPV 16/18 okozza § ≈ 71%-át a méhnyakrák típusainak a HPV 16/18 okozza HSIL = high-grade squamous intraepithelial lesion. CIN = Cervical intraepithelial neoplasia. Adapted from: http: //www. who. int/hpvcentre/statistics (accessed September 2012). CONFIDENTIAL

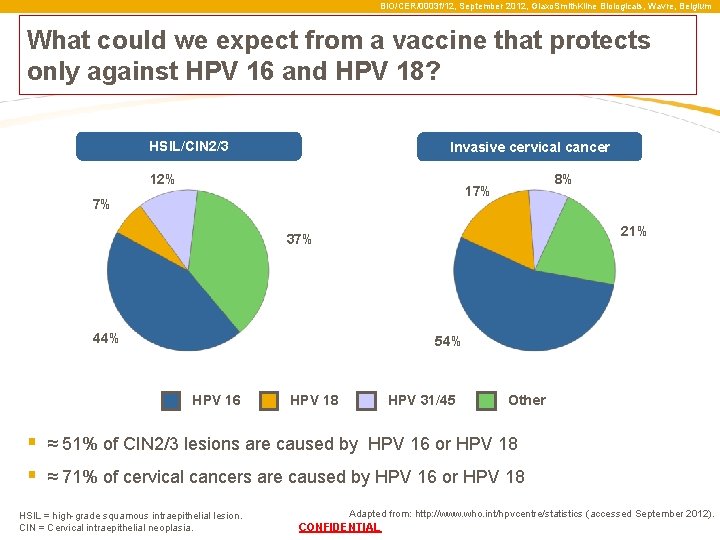
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium What could we expect from a vaccine that protects only against HPV 16 and HPV 18? HSIL/CIN 2/3 Invasive cervical cancer 12% 8% 17% 7% 21% 37% 44% 54% HPV 16 HPV 18 HPV 31/45 Other § ≈ 51% of CIN 2/3 lesions are caused by HPV 16 or HPV 18 § ≈ 71% of cervical cancers are caused by HPV 16 or HPV 18 HSIL = high-grade squamous intraepithelial lesion. CIN = Cervical intraepithelial neoplasia. Adapted from: http: //www. who. int/hpvcentre/statistics (accessed September 2012). CONFIDENTIAL

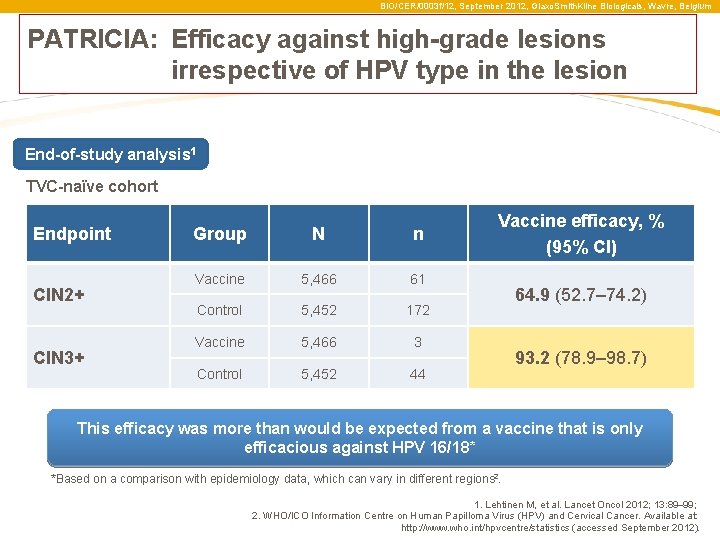
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: a hatékonyság független a HPV törzs típusától End-of-study analysis 1 TVC-naïve cohort Endpoint CIN 2+ CIN 3+ Group N n Vaccine 5, 466 61 Control 5, 452 172 Vaccine 5, 466 3 Control 5, 452 44 Vaccine efficacy, % (95% CI) 64. 9 (52. 7– 74. 2) 93. 2 (78. 9– 98. 7) A tapasztalt hatékonyság messze felülmúlja azt az értéket, ami elvárható volna egy csupán HPV 16/18 ellen védelmet biztosító vakcina esetében* *Based on a comparison with epidemiology data, which can vary in different regions 2. 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99; 2. WHO/ICO Information Centre on Human Papilloma Virus (HPV) and Cervical Cancer. Available at: http: //www. who. int/hpvcentre/statistics (accessed September 2012).

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Efficacy against high-grade lesions irrespective of HPV type in the lesion End-of-study analysis 1 TVC-naïve cohort Endpoint CIN 2+ CIN 3+ Group N n Vaccine 5, 466 61 Control 5, 452 172 Vaccine 5, 466 3 Control 5, 452 44 Vaccine efficacy, % (95% CI) 64. 9 (52. 7– 74. 2) 93. 2 (78. 9– 98. 7) This efficacy was more than would be expected from a vaccine that is only efficacious against HPV 16/18* *Based on a comparison with epidemiology data, which can vary in different regions 2. 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99; 2. WHO/ICO Information Centre on Human Papilloma Virus (HPV) and Cervical Cancer. Available at: http: //www. who. int/hpvcentre/statistics (accessed September 2012).

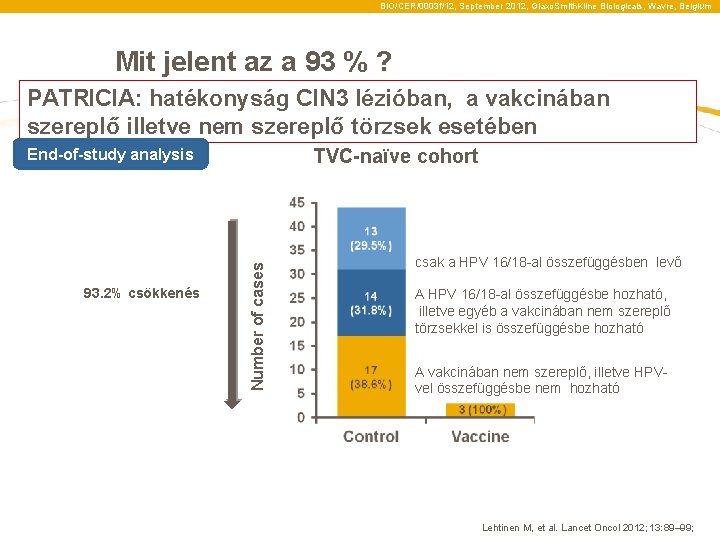
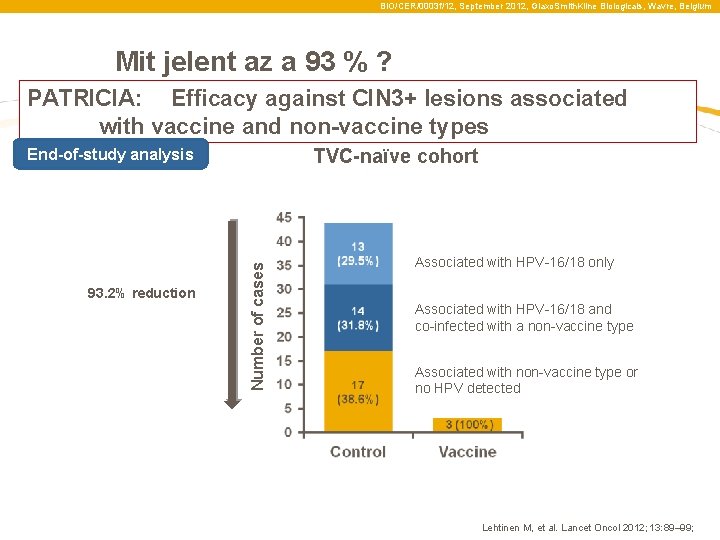
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Mit jelent az a 93 % ? PATRICIA: hatékonyság CIN 3 lézióban, a vakcinában szereplő illetve nem szereplő törzsek esetében TVC-naïve cohort 93. 2% csökkenés Number of cases End-of-study analysis csak a HPV 16/18 -al összefüggésben levő A HPV 16/18 -al összefüggésbe hozható, illetve egyéb a vakcinában nem szereplő törzsekkel is összefüggésbe hozható A vakcinában nem szereplő, illetve HPVvel összefüggésbe nem hozható Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99;

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Mit jelent az a 93 % ? PATRICIA: Efficacy against CIN 3+ lesions associated with vaccine and non-vaccine types TVC-naïve cohort 93. 2% reduction Number of cases End-of-study analysis Associated with HPV-16/18 only Associated with HPV-16/18 and co-infected with a non-vaccine type Associated with non-vaccine type or no HPV detected Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99;

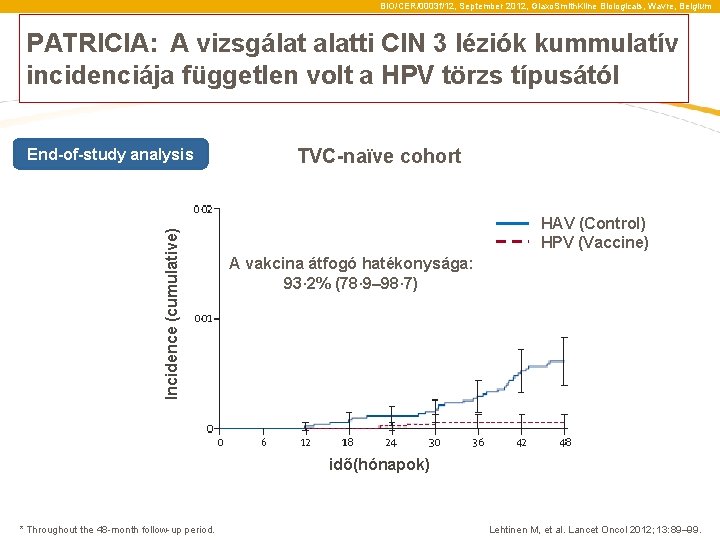
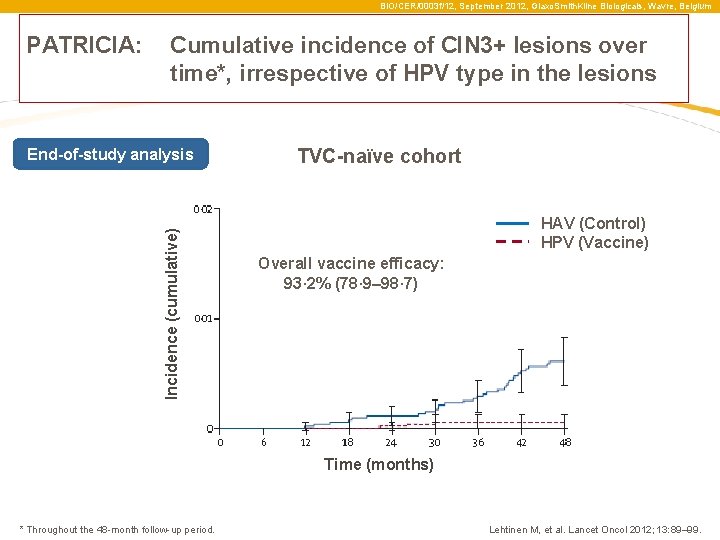
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: A vizsgálat alatti CIN 3 léziók kummulatív incidenciája független volt a HPV törzs típusától Incidence (cumulative) End-of-study analysis TVC-naïve cohort HAV (Control) HPV (Vaccine) A vakcina átfogó hatékonysága: 93· 2% (78· 9– 98· 7) idő(hónapok) * Throughout the 48 -month follow-up period. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Cumulative incidence of CIN 3+ lesions over time*, irrespective of HPV type in the lesions Incidence (cumulative) End-of-study analysis TVC-naïve cohort HAV (Control) HPV (Vaccine) Overall vaccine efficacy: 93· 2% (78· 9– 98· 7) Time (months) * Throughout the 48 -month follow-up period. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

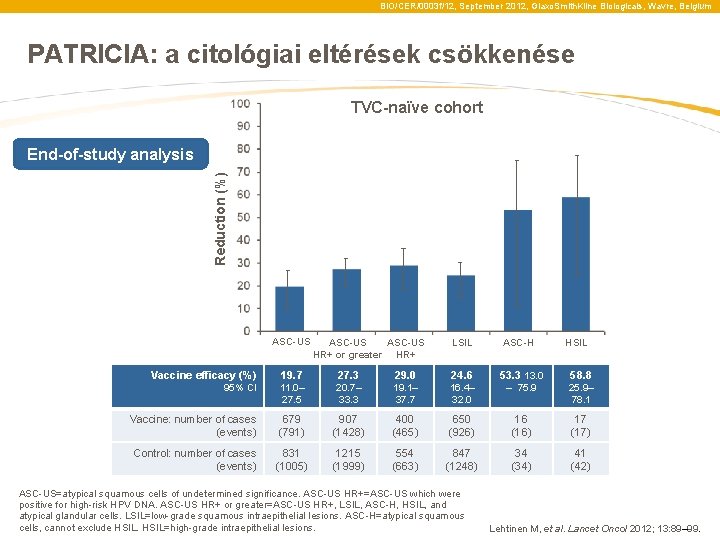
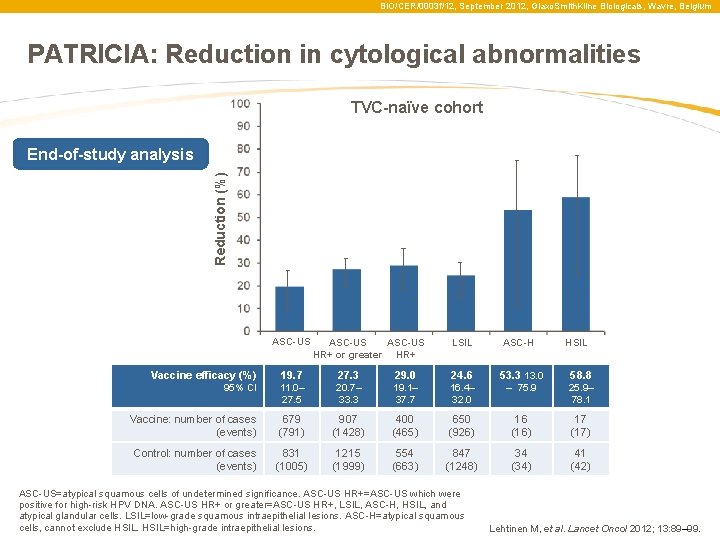
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: a citológiai eltérések csökkenése TVC-naïve cohort Reduction (%) End-of-study analysis ASC-US HR+ or greater HR+ LSIL ASC-H HSIL Vaccine efficacy (%) 19. 7 27. 3 29. 0 24. 6 53. 3 13. 0 58. 8 95% CI 11. 0– 27. 5 20. 7– 33. 3 19. 1– 37. 7 16. 4– 32. 0 – 75. 9 25. 9– 78. 1 Vaccine: number of cases (events) 679 (791) 907 (1428) 400 (465) 650 (926) 16 (16) 17 (17) Control: number of cases (events) 831 (1005) 1215 (1999) 554 (663) 847 (1248) 34 (34) 41 (42) ASC-US=atypical squamous cells of undetermined significance. ASC-US HR+=ASC-US which were positive for high-risk HPV DNA. ASC-US HR+ or greater=ASC-US HR+, LSIL, ASC-H, HSIL, and atypical glandular cells. LSIL=low-grade squamous intraepithelial lesions. ASC-H=atypical squamous cells, cannot exclude HSIL=high-grade intraepithelial lesions. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Reduction in cytological abnormalities TVC-naïve cohort Reduction (%) End-of-study analysis ASC-US HR+ or greater HR+ LSIL ASC-H HSIL Vaccine efficacy (%) 19. 7 27. 3 29. 0 24. 6 53. 3 13. 0 58. 8 95% CI 11. 0– 27. 5 20. 7– 33. 3 19. 1– 37. 7 16. 4– 32. 0 – 75. 9 25. 9– 78. 1 Vaccine: number of cases (events) 679 (791) 907 (1428) 400 (465) 650 (926) 16 (16) 17 (17) Control: number of cases (events) 831 (1005) 1215 (1999) 554 (663) 847 (1248) 34 (34) 41 (42) ASC-US=atypical squamous cells of undetermined significance. ASC-US HR+=ASC-US which were positive for high-risk HPV DNA. ASC-US HR+ or greater=ASC-US HR+, LSIL, ASC-H, HSIL, and atypical glandular cells. LSIL=low-grade squamous intraepithelial lesions. ASC-H=atypical squamous cells, cannot exclude HSIL=high-grade intraepithelial lesions. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99.

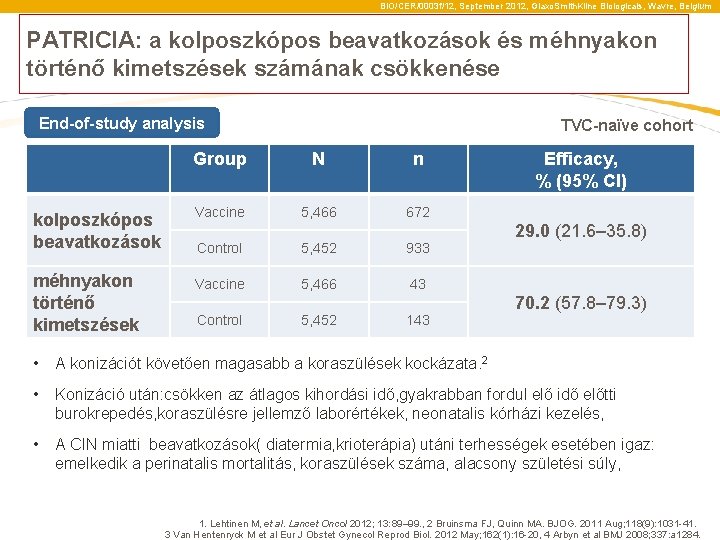
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: a kolposzkópos beavatkozások és méhnyakon történő kimetszések számának csökkenése End-of-study analysis TVC-naïve cohort Group N n kolposzkópos beavatkozások Vaccine 5, 466 672 Control 5, 452 933 méhnyakon történő kimetszések Vaccine 5, 466 43 Efficacy, % (95% CI) 29. 0 (21. 6– 35. 8) 70. 2 (57. 8– 79. 3) Control 5, 452 143 • A konizációt követően magasabb a koraszülések kockázata. 2 • Konizáció után: csökken az átlagos kihordási idő, gyakrabban fordul elő idő előtti burokrepedés, koraszülésre jellemző laborértékek, neonatalis kórházi kezelés, • A CIN miatti beavatkozások( diatermia, krioterápia) utáni terhességek esetében igaz: emelkedik a perinatalis mortalitás, koraszülések száma, alacsony születési súly, 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99. , 2 Bruinsma FJ, Quinn MA. BJOG. 2011 Aug; 118(9): 1031 -41. 3 Van Hentenryck M et al Eur J Obstet Gynecol Reprod Biol. 2012 May; 162(1): 16 -20, 4 Arbyn et al BMJ 2008; 337: a 1284.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium PATRICIA: Reduction in colposcopy referrals and cervical excision procedures End-of-study analysis TVC-naïve cohort Group N n Colposcopy referrals Vaccine 5, 466 672 Control 5, 452 933 Cervical excision procedures Vaccine 5, 466 43 Efficacy, % (95% CI) 29. 0 (21. 6– 35. 8) 70. 2 (57. 8– 79. 3) Control 5, 452 143 • Women treated using excisional treatments are at a higher risk of preterm birth. 2 • Women post-conization: significant reduction in mean gestational age at delivery, higher rate of premature rupture of the membrane, premature onset of labor, premature delivery and neonatal hospitalization including ICU admission 3 • Women who become pregnant after treatment for CIN with cold knife conisation and radical diathermy have an increased risk of perinatal mortality, severe preterm delivery, and extreme low birthweight infants 4 1. Lehtinen M, et al. Lancet Oncol 2012; 13: 89– 99. , 2 Bruinsma FJ, Quinn MA. BJOG. 2011 Aug; 118(9): 1031 -41. 3 Van Hentenryck M et al Eur J Obstet Gynecol Reprod Biol. 2012 May; 162(1): 16 -20, 4 Arbyn et al BMJ 2008; 337: a 1284.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix™: biztonságossági profil § A vizsgálatok 30 ezer, 10 - 72 éves nő bevonásával történtek § A vakcinával kapcsolatba hozható mellékhatások többsége enyhe és középes fokú volt, és átmeneti jellegű – A leggyakoribb az oltás helyén fellépő reakció, fejfájás, izomfájdalom volt § A Cervarix esetében a terhességben történő alkalmazásra vonatkozó adatok nem elégségesek, ezért a készítményt nem javasolt terhesség alatt alkalmazni § A GSK folyamatosan monitorozza az oltás után fellépő oltási reakciókat, mellékhatásokat EMA. Cervarix®. European Summary of Product Characteristics, 2012.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix™: Safety profile § Safety was monitored in clinical studies enrolling ≈ 30, 000 subjects aged 10– 72 years who had received Cervarix™ or control § The majority of vaccine-related adverse reactions were of mild to moderate severity and were not long lasting – The most common were injection site reactions, headache and myalgia § Data on Cervarix™ administered during pregnancy are insufficient to recommend use of the vaccine during pregnancy § A GSK folyamatosan monitorozza az oltás után fellépő oltási reakciókat, mellékhatásokat EMA. Cervarix®. European Summary of Product Characteristics, 2012.

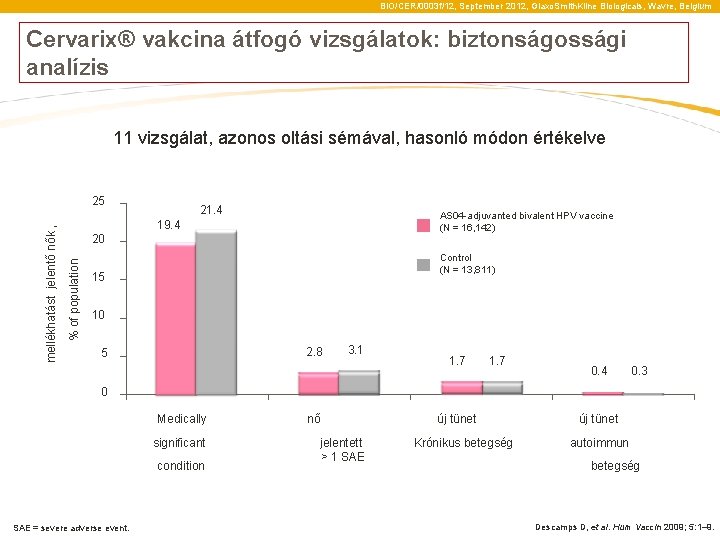
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix® vakcina átfogó vizsgálatok: biztonságossági analízis 11 vizsgálat, azonos oltási sémával, hasonló módon értékelve 21. 4 AS 04 -adjuvanted bivalent HPV vaccine (N = 16, 142) 19. 4 20 % of population mellékhatást jelentő nők , 25 Control (N = 13, 811) 15 10 2. 8 5 3. 1 1. 7 0. 4 0. 3 0 Medically significant condition SAE = severe adverse event. nő jelentett > 1 SAE új tünet Krónikus betegség új tünet autoimmun betegség Descamps D, et al. Hum Vaccin 2009; 5: 1– 9.

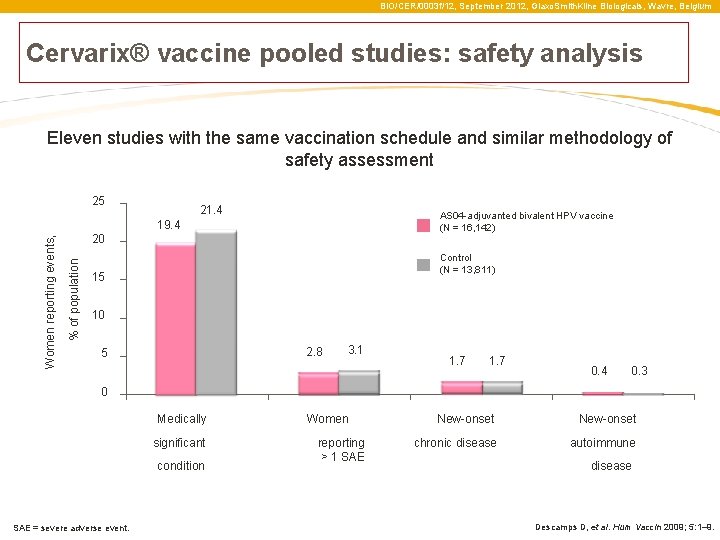
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Cervarix® vaccine pooled studies: safety analysis Eleven studies with the same vaccination schedule and similar methodology of safety assessment 21. 4 AS 04 -adjuvanted bivalent HPV vaccine (N = 16, 142) 19. 4 20 % of population Women reporting events, 25 Control (N = 13, 811) 15 10 2. 8 5 3. 1 1. 7 0. 4 0. 3 0 Medically significant condition SAE = severe adverse event. Women reporting > 1 SAE New-onset chronic disease autoimmune disease Descamps D, et al. Hum Vaccin 2009; 5: 1– 9.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Label update based on the VIVIANE trial § VIVIAN Interim Efficacy Analysis (M 48) women >25 years: The section 5. 1 Pharmacodynamic properties of the Sm. PC has been updated efficacy data in women aged 26 years and above § 6 -month persistent infection data § Immunogenicity data üEU Commission Decision issued on September 17, 2012 CONFIDENTIAL

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Label update based on the VIVIANE trial § VIVIAN Interim Efficacy Analysis (M 48) women >25 years: The section 5. 1 Pharmacodynamic properties of the Sm. PC has been updated efficacy data in women aged 26 years and above § 6 -month persistent infection data § Immunogenicity data üEU Commission Decision issued on September 17, 2012 CONFIDENTIAL

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Legutóbbi módosítás 2013. március 27 § Indikáció (4. 1) : § A Cervarix vakcina 9 éves kortól adva egyes onkogén Humán papillomavírus (HPV) típusok által okozott perzisztáló fertőzés, premalignus genitalis (cervicalis, vulvaris és vaginalis) léziók és a cervix carcinoma prevenciójára szolgál. A javallatot alátámasztó adatokkal kapcsolatos fontos információkért lásd a 4. 4 és az 5. 1. pontot. § Egyéb változások : § Becslések szerint a HPV-16 és a HPV-18 felelős a méhnyakrák kb. 70%-áért és a HPV-vel összefüggő nagyfokú vulvaris és vaginalis intraepithelialis neoplasiák 70%-áért. Egyéb onkogén HPV típusok szintén okozhatnak méhnyakrákot (kb. 30% arányban). A HPV-45, -31 és -33 a három leggyakoribb, vakcina által le nem fedett típus, amelyeket a laphám eredetű méhnyakrákokban (12, 1%) és az adenocarcinomákban (8, 5) kimutattak. § A 4. 1 pontban szereplő „premalignus genitalis laesiók” kifejezés a nagyfokú Cervicalis Intraepithelialis Neoplasiának (CIN 2/3), a nagyfokú vulvaris intraepitheliális neoplasiának (VIN 2/3) és a nagyfokú vaginalis intraepithelialis neoplasiának (Va. IN 2/3) felel meg. § A vizsgálati elemzés végén az ATP-kohortban a vakcina-csoportban 2 HPV-16 -tal vagy HPV-18 al összefüggő VIN 2+ vagy Va. IN 2 esetet, míg a kontroll-csoportban 7 esetet figyeltek meg. A vizsgálat nem rendelkezett olyan statisztikai erővel, hogy ezekben a végpontokban bizonyítsa a különbséget a vakcina- és a kontoll-csoport között

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Következtetések § Fázis II, III, vizsgálatok az elmúlt tíz évben: Ø Folyamatosan magas HPV 16/18 elleni ellenanyagszintek, (9, 4 év, medián 8, 9 év) Ø Magas hatékonyság a HPV 16/18 törzsekkel szemben CIN 2+/CIN 3+ lézióban – 99% and 100% HPV 16/18 ellen CIN 2+ and CIN 3+, esetén (TVC-naïve) Ø A vakcina 93. 2%-os hatékonysága CIN 3+ esetén független a HPV törzs típusától (TVC-naïve cohort) § Cervarix™ általánosságban jól tolerálható, megfelelő klinikai biztonságossági profillal rendelkezik * In an analysis of CIN 3+ lesions, conducted irrespective of HPV type, Cervarix™ showed 93% efficacy (95% CI: 78. 9– 98. 7)

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Conclusions § In Phase II and III studies conducted over a period of approximately 10 years, Cervarix™ has demonstrated: Ø Consistently high HPV 16/18 antibody levels up to 9. 4 years (median 8. 9 years) Ø Sustained high efficacy against HPV 16/18 related CIN 2+/CIN 3+ lesions – 99% and 100% against HPV 16/18 CIN 2+ and CIN 3+, (TVC-naïve Ø 93. 2% vaccine efficacy against CIN 3+ in the TVC-naïve cohort, irrespective of HPV type* § Cervarix™ is generally well tolerated with a clinically acceptable safety profile * In an analysis of CIN 3+ lesions, conducted irrespective of HPV type, Cervarix™ showed 93% efficacy (95% CI: 78. 9– 98. 7)

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Első hatékonysági adatok Angliából, Skóciából § 3 éves tender (2008 -2011) § Magas átoltottság elérése – 80% a 12/13 éves lányok esetében – >50% felzárkóztatóan 17 éves korig § HPV vakcina és daganat regiszter + figyelőszolgálat kezdeményezése: – HPA (England) and HPS (Scotland) § szervezett méhnyak rák szűrés indul: – 25 éves kortól, Anglia – 20 éves kortól, Skócia

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium First Cervarix effectiveness data from UK England Scotland § Three-year tender (2008 -2011) § High coverage achieved – 80% for 12/13 year-old girls – >50% for catch-up to age 17 § HPV vaccine and cancer registries + surveillance initiated by – HPA (England) and HPS (Scotland) § Organized cervical cancer screening starting – at age 25 in England – at age 20 in Scotland

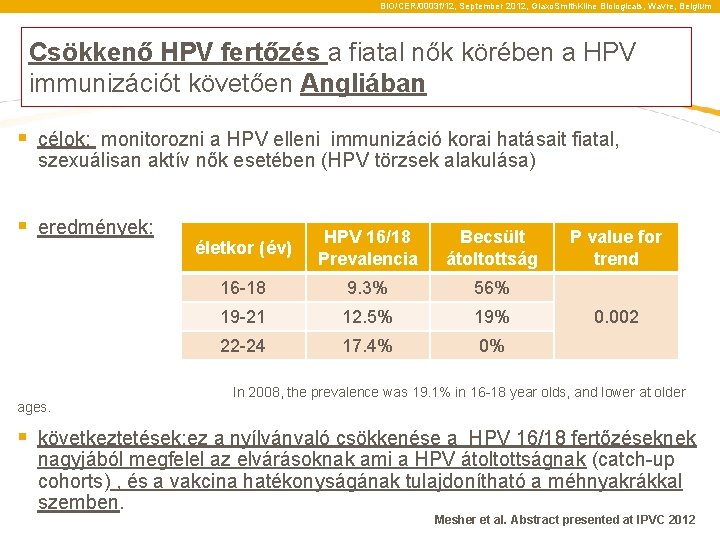
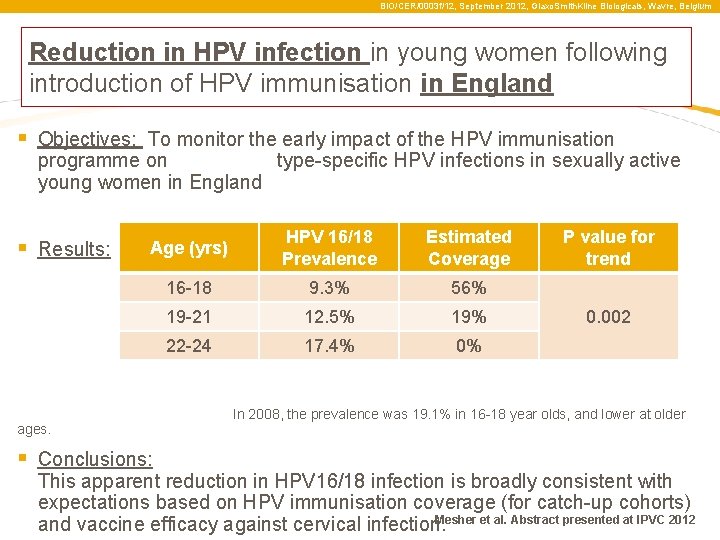
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Csökkenő HPV fertőzés a fiatal nők körében a HPV immunizációt követően Angliában § célok: monitorozni a HPV elleni immunizáció korai hatásait fiatal, szexuálisan aktív nők esetében (HPV törzsek alakulása) § eredmények: ages. életkor (év) HPV 16/18 Prevalencia Becsült átoltottság 16 -18 9. 3% 56% 19 -21 12. 5% 19% 22 -24 17. 4% 0% P value for trend 0. 002 In 2008, the prevalence was 19. 1% in 16 -18 year olds, and lower at older § következtetések: ez a nyílvánvaló csökkenése a HPV 16/18 fertőzéseknek nagyjából megfelel az elvárásoknak ami a HPV átoltottságnak (catch-up cohorts) , és a vakcina hatékonyságának tulajdonítható a méhnyakrákkal szemben. Mesher et al. Abstract presented at IPVC 2012

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Reduction in HPV infection in young women following introduction of HPV immunisation in England § Objectives: To monitor the early impact of the HPV immunisation programme on type-specific HPV infections in sexually active young women in England § Results: Age (yrs) HPV 16/18 Prevalence Estimated Coverage 16 -18 9. 3% 56% 19 -21 12. 5% 19% 22 -24 17. 4% 0% ages. § Conclusions: P value for trend 0. 002 In 2008, the prevalence was 19. 1% in 16 -18 year olds, and lower at older This apparent reduction in HPV 16/18 infection is broadly consistent with expectations based on HPV immunisation coverage (for catch-up cohorts) Mesher et al. Abstract presented at IPVC 2012 and vaccine efficacy against cervical infection.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium a bemutatott és biztosított magas lefedettség a kétkomponensű HPV vakcina által, a HPV 16/18 és a hozzá közeli törzsek prevalenciáját csökkentette Skóciában § A program első három évében Skóciában, a 3 adag oltóanyagot a 1213 éves lányok több, mint 90%-a megkapta § Az iskolát éppen elhagyók között kevesebben lettek beoltva (30 -50% részesült oltásban), ez kedvezőbb, mint Angliában ennek a korcsoportnak az oltottsága § Az előzetes analízisek alapján elmondható, hogy a vakcina csökkentette a HPV 16/18 törzsek prevalenciáját, és kereszt védelmet biztosít más magaskockázatú törzsekkel szemben is (31, 33, 45) CONFIDENTIAL Cuschieri et al. Abstract presented at IPVC 2012

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Introduction and sustained high coverage of the HPV bivalent vaccine in Scotland leads to a reduction in prevalence of HPV 16/18 and closely related types § For the first three years of the programme in Scotland, routine HPV vaccine uptake of all 3 doses has been sustained at the high levels (>90%) in the 12 -13 age group. § Among school leavers where there was lower uptake (between 3050%), coverage still compares favourably with previous vaccines targeted at this age group in the UK. § Az előzetes analízisek alapján elmondható, hogy a vakcina csökkentette a HPV 16/18 törzsek prevalenciáját, és kereszt védelmet biztosít más magaskockázatú törzsekkel szemben is (31, 33, 45) CONFIDENTIAL Cuschieri et al. Abstract presented at IPVC 2012

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Következtetések: § These reports provide evidence of the early impact on HPV 16/18 infection as well as HPV 31, 33, 45, with high coverage, following implementation of Cervarix § Results are reassuring and seem to be consistent with vaccine efficacy seen in clinical trials § Further analyses on abnormal Pap and CIN expected in the coming years CONFIDENTIAL

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Következtetések: § ez a riport még egyértelműbbé teszi a Cervarix vakcina alkalmazása kapcsán a HPV 16/18 illetve a 31, 33, 45 törzsek esetében a korai hatást. § Az eredmények megnyugtatóak, és egybevágnak azzal, amit a hatékonyságról a klinikai vizsgálatok mutatnak § További analízisek várhatóak a jövőben (Pap, CIN elemzés) CONFIDENTIAL

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Milyen szempontokat mérlegelünk méhnyakrák elleni vakcináció esetén? § Minél több méhnyakrákot előzzön meg (hatékonyság) § Védjen hosszú távon § Csökkentse a méhnyakon végzett kisműtétek számát § Legyen biztonságos

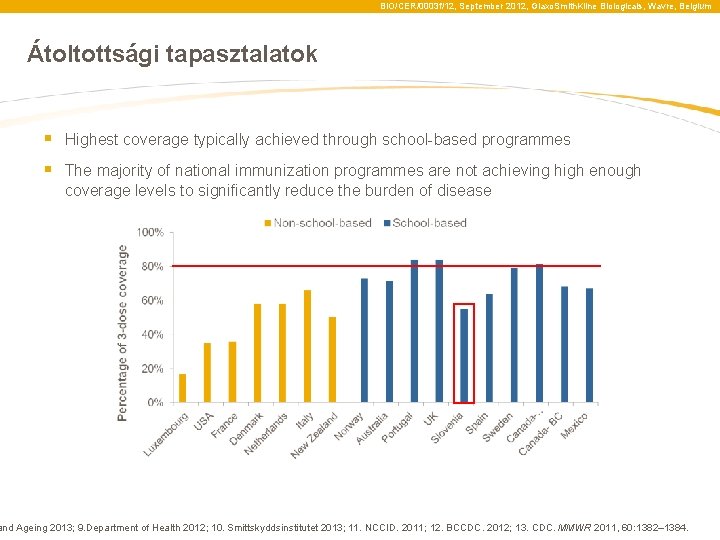
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Átoltottsági tapasztalatok § Highest coverage typically achieved through school-based programmes § The majority of national immunization programmes are not achieving high enough coverage levels to significantly reduce the burden of disease and Ageing 2013; 9. Department of Health 2012; 10. Smittskyddsinstitutet 2013; 11. NCCID. 2011; 12. BCCDC. 2012; 13. CDC. MMWR 2011, 60: 1382– 1384.

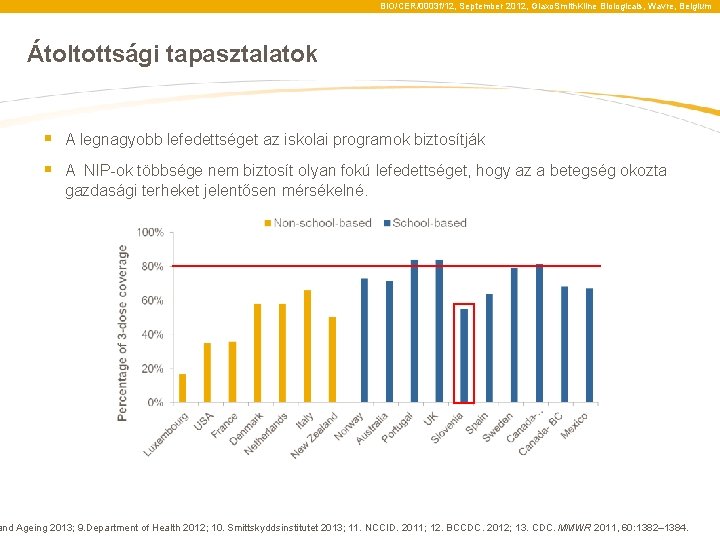
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Átoltottsági tapasztalatok § A legnagyobb lefedettséget az iskolai programok biztosítják § A NIP-ok többsége nem biztosít olyan fokú lefedettséget, hogy az a betegség okozta gazdasági terheket jelentősen mérsékelné. and Ageing 2013; 9. Department of Health 2012; 10. Smittskyddsinstitutet 2013; 11. NCCID. 2011; 12. BCCDC. 2012; 13. CDC. MMWR 2011, 60: 1382– 1384.

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Átoltottság – Magyarország 2012. december § 12 -28 év: 11, 4% § 12 -18 év: 26, 1% § 19 -28 év: 4, 9% § eddig összesen oltott a két vakcinával teljes oltási sort kapott kislány, hölgy : 116 958

Cervarix in vaccination programs § Cervarix is currently used in national immunisation programmes in: Netherlands, Peru, Panama, Argentina, Iceland, Izrael, Mexico and regional programmes in Italy, Spain, Monaco, Belgium and Bermuda amongst others § 100%-ban támogatott Németország, Franciaország, Románia, Bulgária, Csehország § Cervarix has been selected as vaccine for British Columbia's new cervical cancer prevention program for young women

A Cervarix az oltási programban § Cervarixot a következő államokban alkalmazzák a NIP kapcsán: Hollandia, Peru, Panama, Argentina, Izland, Izrael, Mexikó, Olaszország egyes régióiban, Spanyolország, Monaco, Belgium, Bermuda § 100%-ban támogatott: Németország, Franciaország, Románia, Bulgária, Csehország § A Cervarixra esett a választás a British Columbiában induló új méhnyak rák megelőzési programban, melynek célcsoportja a fiatal lányok

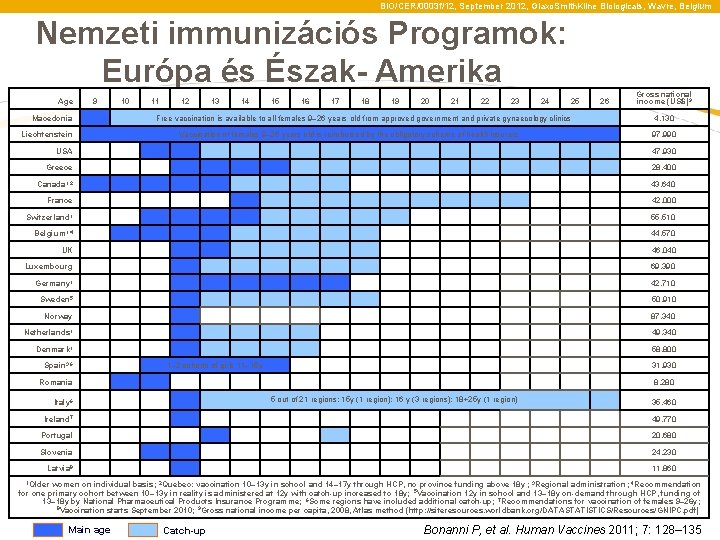
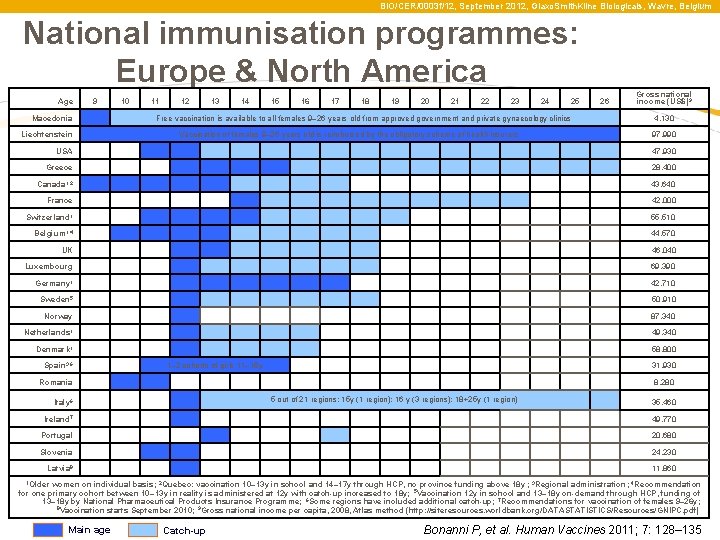
BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium Nemzeti immunizációs Programok: Európa és Észak- Amerika Age 9 10 11 Macedonia 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Free vaccination is available to all females 9– 26 years old from approved government and private gynaecology clinics Liechtenstein Gross national income (US$)9 4, 130 Vaccination of females 9– 26 years old is reimbursed by the obligatory scheme of health insurers 97, 990 USA 47, 930 Greece 28, 400 Canada 1, 2 43, 640 France 42, 000 Switzerland 1 55, 510 Belgium 1, 4 44, 570 UK 46, 040 Luxembourg 69, 390 Germany 1 42, 710 Sweden 5 50, 910 Norway 87, 340 Netherlands 1 49, 340 Denmark 1 58, 800 Spain 3, 6 31, 930 Romania 8, 280 1– 2 cohorts of girls 11– 15 y 5 out of 21 regions: 15 y (1 region); 16 y (3 regions); 18+25 y (1 region) Italy 6 35, 460 Ireland 7 Portugal 49, 770 20, 680 Slovenia 24, 230 Latvia 8 11, 860 1 Older women on individual basis; 2 Quebec: vaccination 10– 13 y in school and 14– 17 y through HCP, no province funding above 18 y ; 3 Regional administration; 4 Recommendation for one primary cohort between 10– 13 y in reality is administered at 12 y with catch-up increased to 18 y; 5 Vaccination 12 y in school and 13– 18 y on-demand through HCP, funding of 13– 18 y by National Pharmaceutical Products Insurance Programme; 6 Some regions have included additional catch-up; 7 Recommendations for vaccination of females 9– 26 y; 8 Vaccination starts September 2010; 9 Gross national income per capita, 2008, Atlas method (http: //siteresources. worldbank. org/DATASTATISTICS/Resources/GNIPC. pdf) Main age Catch-up Bonanni P, et al. Human Vaccines 2011; 7: 128– 135

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium National immunisation programmes: Europe & North America Age 9 10 11 Macedonia 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Free vaccination is available to all females 9– 26 years old from approved government and private gynaecology clinics Liechtenstein Gross national income (US$)9 4, 130 Vaccination of females 9– 26 years old is reimbursed by the obligatory scheme of health insurers 97, 990 USA 47, 930 Greece 28, 400 Canada 1, 2 43, 640 France 42, 000 Switzerland 1 55, 510 Belgium 1, 4 44, 570 UK 46, 040 Luxembourg 69, 390 Germany 1 42, 710 Sweden 5 50, 910 Norway 87, 340 Netherlands 1 49, 340 Denmark 1 58, 800 Spain 3, 6 31, 930 Romania 8, 280 1– 2 cohorts of girls 11– 15 y 5 out of 21 regions: 15 y (1 region); 16 y (3 regions); 18+25 y (1 region) Italy 6 35, 460 Ireland 7 Portugal 49, 770 20, 680 Slovenia 24, 230 Latvia 8 11, 860 1 Older women on individual basis; 2 Quebec: vaccination 10– 13 y in school and 14– 17 y through HCP, no province funding above 18 y ; 3 Regional administration; 4 Recommendation for one primary cohort between 10– 13 y in reality is administered at 12 y with catch-up increased to 18 y; 5 Vaccination 12 y in school and 13– 18 y on-demand through HCP, funding of 13– 18 y by National Pharmaceutical Products Insurance Programme; 6 Some regions have included additional catch-up; 7 Recommendations for vaccination of females 9– 26 y; 8 Vaccination starts September 2010; 9 Gross national income per capita, 2008, Atlas method (http: //siteresources. worldbank. org/DATASTATISTICS/Resources/GNIPC. pdf) Main age Catch-up Bonanni P, et al. Human Vaccines 2011; 7: 128– 135

BIO/CER/0003 f/12, September 2012, Glaxo. Smith. Kline Biologicals, Wavre, Belgium