A gzok rendezetlen hmozgst vgz rszecskkbl llnak A
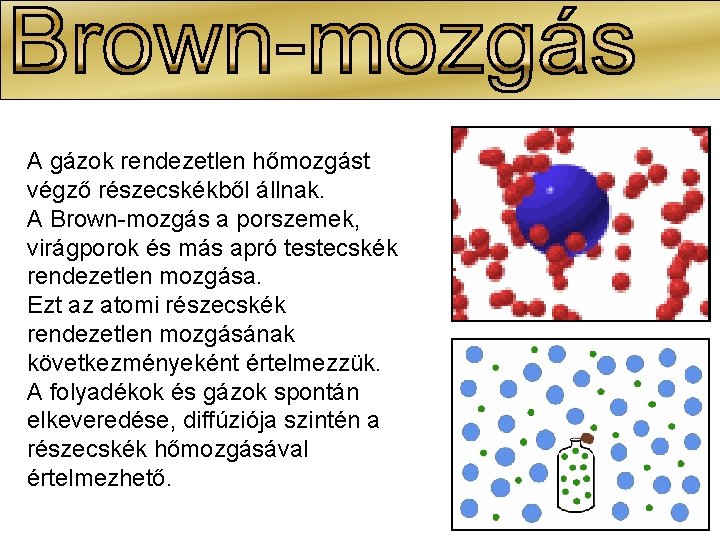
A gázok rendezetlen hőmozgást végző részecskékből állnak. A Brown-mozgás a porszemek, virágporok és más apró testecskék rendezetlen mozgása. Ezt az atomi részecskék rendezetlen mozgásának következményeként értelmezzük. A folyadékok és gázok spontán elkeveredése, diffúziója szintén a részecskék hőmozgásával értelmezhető.

A gázrészecskék rendezetlen hőmozgásuk során rugalmasan ütköznek egymással és az edény falával. A sebességváltozás lendületváltozást is jelent, amely erőhatást eredményez az ütköző részecske és a fal között. Ezt az erőhatást nyomásként érzékeljük. A részecskék által kifejtett nyomás függ: a részecskék sebességétől, a részecskék számától.
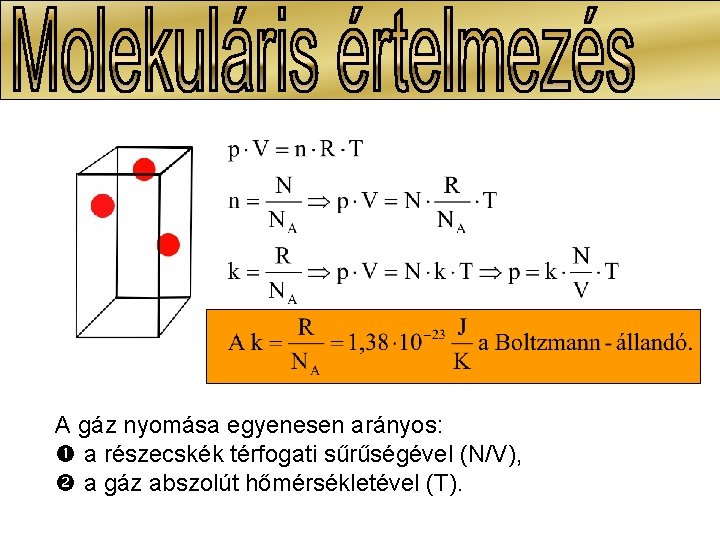
A gáz nyomása egyenesen arányos: a részecskék térfogati sűrűségével (N/V), a gáz abszolút hőmérsékletével (T).

Az izoterm ( T = állandó) állapotváltozásoknál a térfogatváltozással együttjáró részecskesűrűség megváltozása okozza a nyomás változását. Az izochor ( V = állandó) állapotváltozásoknál a részecskék rendezetlen hőmozgásának átlagos sebességváltozása okozza a gáz nyomásának változását. Az izobár ( p = állandó) állapotváltozásoknál a részecskesűrűség változását a hőmozgás átlagos sebességének változása egyenlíti ki, ezért marad állandó a gáz nyomása.
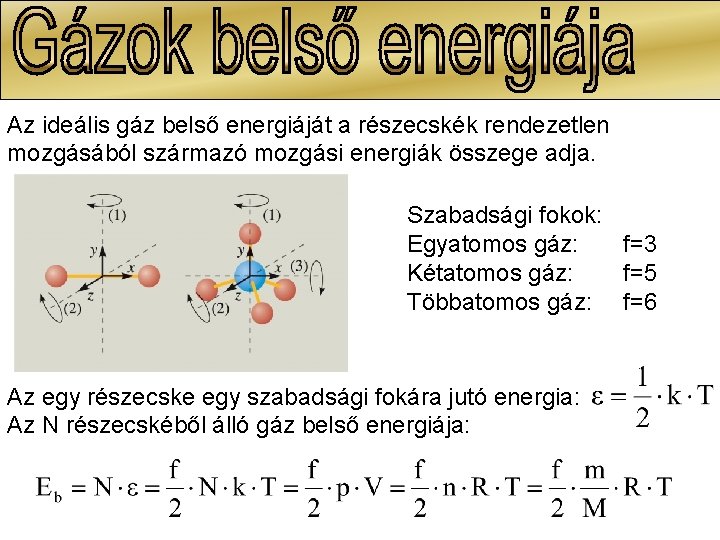
Az ideális gáz belső energiáját a részecskék rendezetlen mozgásából származó mozgási energiák összege adja. Szabadsági fokok: Egyatomos gáz: f=3 Kétatomos gáz: f=5 Többatomos gáz: f=6 Az egy részecske egy szabadsági fokára jutó energia: Az N részecskéből álló gáz belső energiája:
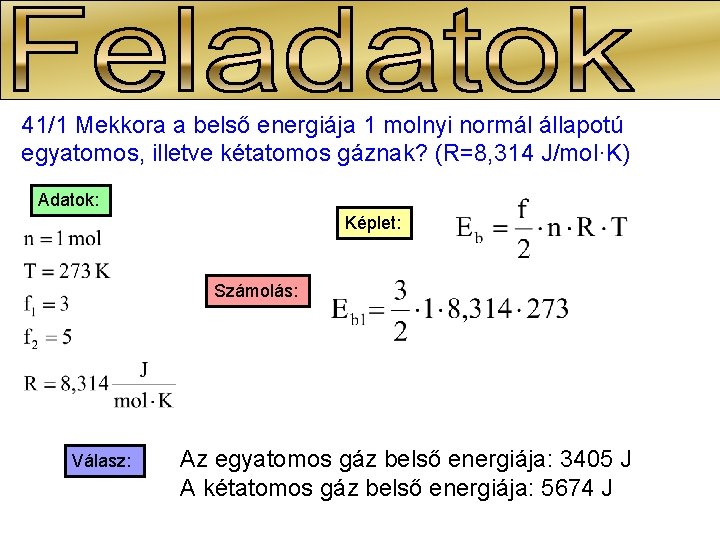
41/1 Mekkora a belső energiája 1 molnyi normál állapotú egyatomos, illetve kétatomos gáznak? (R=8, 314 J/mol·K) Adatok: Képlet: Számolás: Válasz: Az egyatomos gáz belső energiája: 3405 J A kétatomos gáz belső energiája: 5674 J

41/2 Becsüljük meg egy 4 m X 5 m X 3 m méretű szobában lévő levegő belső energiáját! Adatok: Képlet: Számolás: Válasz: A szoba levegőjének belső energiája: 15· 106 J
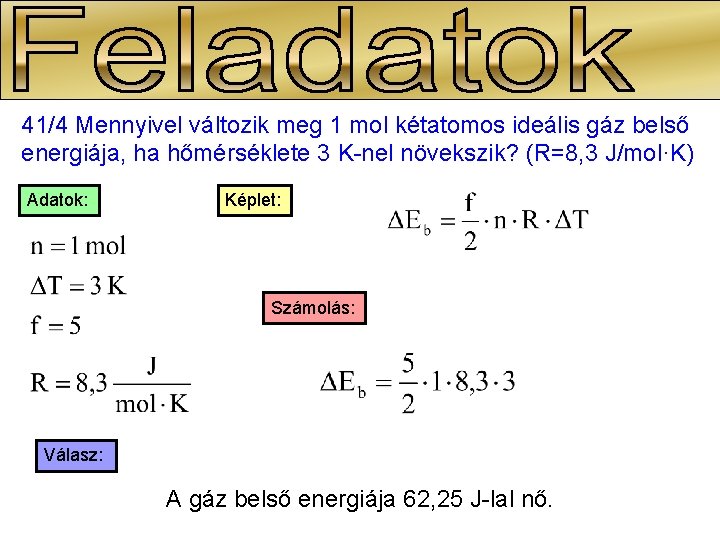
41/4 Mennyivel változik meg 1 mol kétatomos ideális gáz belső energiája, ha hőmérséklete 3 K-nel növekszik? (R=8, 3 J/mol·K) Adatok: Képlet: Számolás: Válasz: A gáz belső energiája 62, 25 J-lal nő.

41/5 5 mol normál állapotú egyatomos ideális gáz belső energiája melegítés során 10%-kal nő. Mekkora a gáz hőmérséklete melegítés végén? Adatok: Képlet: Számolás: Válasz: A gáz hőmérséklete a melegítés végén: 27, 3°C.
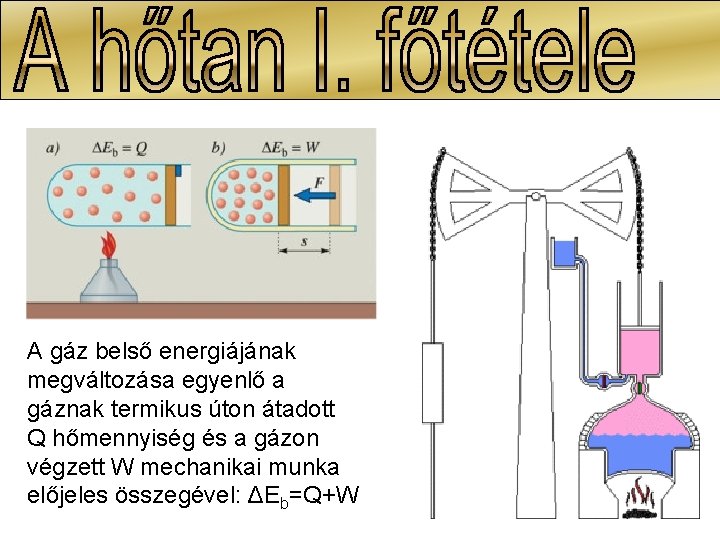
A gáz belső energiájának megváltozása egyenlő a gáznak termikus úton átadott Q hőmennyiség és a gázon végzett W mechanikai munka előjeles összegével: ΔEb=Q+W
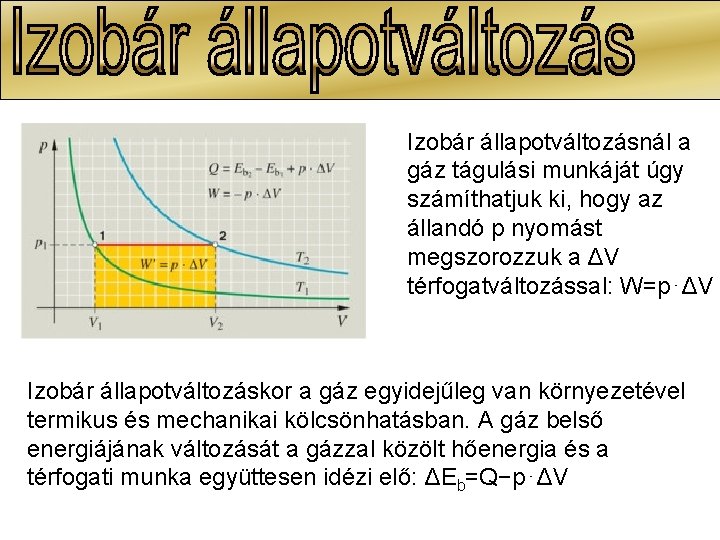
Izobár állapotváltozásnál a gáz tágulási munkáját úgy számíthatjuk ki, hogy az állandó p nyomást megszorozzuk a ΔV térfogatváltozással: W=p⋅ΔV Izobár állapotváltozáskor a gáz egyidejűleg van környezetével termikus és mechanikai kölcsönhatásban. A gáz belső energiájának változását a gázzal közölt hőenergia és a térfogati munka együttesen idézi elő: ΔEb=Q−p⋅ΔV
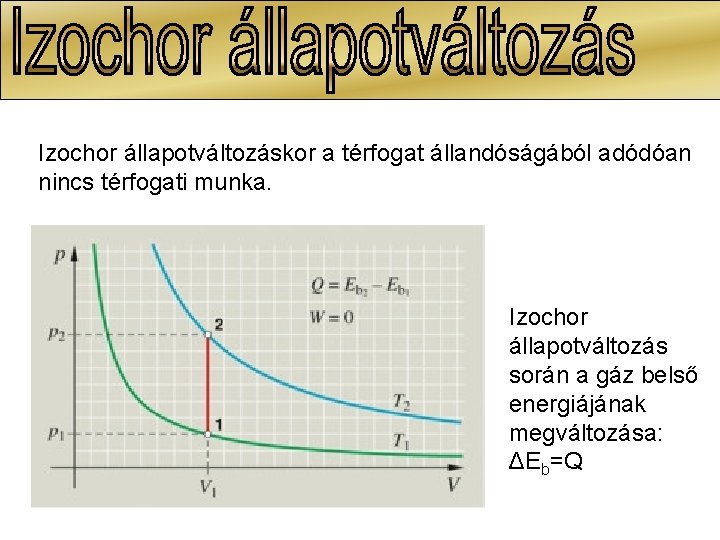
Izochor állapotváltozáskor a térfogat állandóságából adódóan nincs térfogati munka. Izochor állapotváltozás során a gáz belső energiájának megváltozása: ΔEb=Q
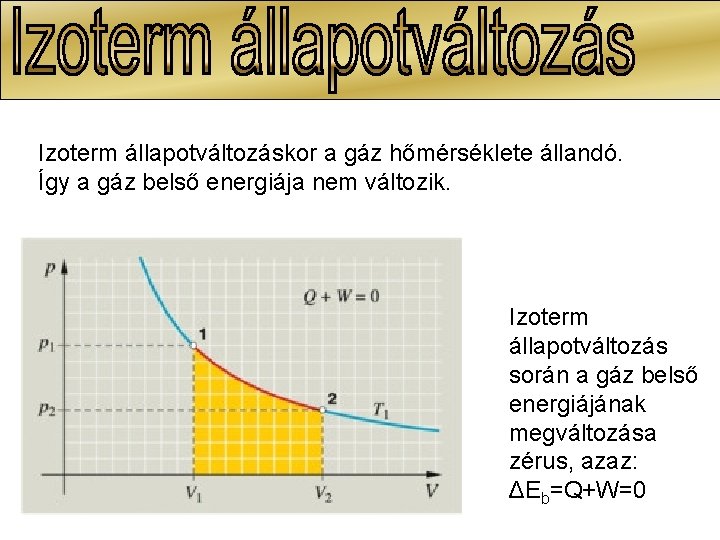
Izoterm állapotváltozáskor a gáz hőmérséklete állandó. Így a gáz belső energiája nem változik. Izoterm állapotváltozás során a gáz belső energiájának megváltozása zérus, azaz: ΔEb=Q+W=0
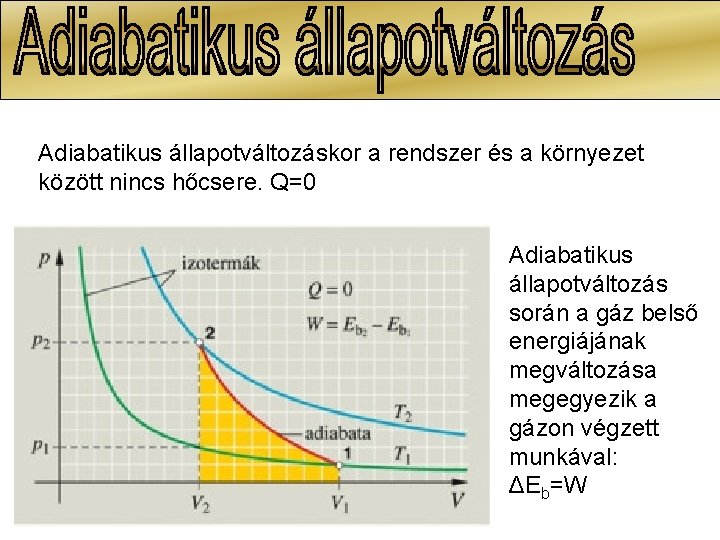
Adiabatikus állapotváltozáskor a rendszer és a környezet között nincs hőcsere. Q=0 Adiabatikus állapotváltozás során a gáz belső energiájának megváltozása megegyezik a gázon végzett munkával: ΔEb=W

47/3 2 mol kétatomos, normál állapotú ideális gázt állandó nyomáson 27°C hőmérsékletre melegítünk. a) Mennyivel változott meg a gáz belső energiája? b) Mennyi hőt közöltünk a gázzal? Képlet: Számolás: Adatok: Válasz: A gáz belső energiája 1122 J-lal nőtt, a gázzal 1571 J hőt közöltünk.

47/4 Egyatomos gáz állandó nyomáson történő melegítése során a gáz 200 J tágulási munkát végzett. Mennyivel változott meg a gáz belső energiája? Mennyi hőt közöltünk a gázzal? Adatok: Képlet: Számolás: Válasz: A gázzal 500 J hőt közöltünk, belső energia 300 J-lal nőtt.

Kérdés: Miért fagy rá a kezünk a szénsavas patronra, amikor szódát készítünk? Válasz: A patronban nyomás alatt lévő szén-dioxid gáz van. Amikor szódát csinálunk, a gáz kiszabadul a patronból, kiterjed, és térfogati munkát végez. Ez a belső energia csökkenésével jár, a patron lehül. Kérdés: Előfordulhat-e, hogy egy gázt melegítünk (termikus kölcsönhatásban hőt kap), mégis lehűl? Válasz: Igen, abban az esetben, ha a folyamat közben a gáz több mechanikai munkát végez, mint amennyi hőt környezetétől kap. Ebben az esetben a hiányzó energiát a belső energiából fedezi, tehát lehűl.

Egy adott anyag fajhője megmutatja, hogy mekkora hőmennyiség felvételére vagy leadására van szükség ahhoz, hogy az 1 kg tömegű anyag hőmérséklete 1°C -kal változzon. A gázok fajhője nem csak az anyagi minőségtől, hanem a hőközlés módjától is függ. Izobár állapotváltozásoknál a gázok fajhője nagyobb, mint az izochor állapotváltozások esetén ( cp > cv ).

Kérdés: A tenger partvidékén sokkal kisebb a téli és a nyári hőmérséklet közötti ingadozás, mint kontinentális éghajlati viszonyok között. Miért? Válasz: A víz fajhője sokkal nagyobb, mint a talajé, ezért lassabban melegszik fel, de lassabban is hűl le. Nyáron a lassabban melegedő víz a tengerpart környékén hűti, télen pedig a lassúbb lehűlés miatt melegíti a levegőt. Kérdés: Egy szoba szellőztetése során hogyan változik meg a szoba levegőjének, és a szobában lévő szilárd anyagok és folyadékok belső energiája? Válasz: Mivel a p·V szorzat állandó a szobában lévő levegő belső energiája nem változik. A szoba tárgyainak belsőenergiacsökkenését a szobából távozó levegő viszi magával.

- Jean, hány fok van idebent? - 18 fok, uram. - És odakint? - 2 fok uram. - Jean, akkor legyen szíves nyissa ki az ablakot, és engedje be azt a két fokot is!

Termikus kölcsönhatás során mindig a melegebb test ad át energiát a hidegebb testnek. Az energiacsere folyamatának ez az iránya – magától, külső beavatkozás nélkül – nem megfordítható. A mechanikai energia teljes egészében belső energiává alakulhat, belső energia nem alakulhat vissza teljes egészében mechanikai energiává.

A hőtan második főtétele szerint másodfajú perpetuum mobile nem készíthető. A hőerőgépek energiaátalakító berendezések, a termikus energiát alakítják át mechanikai energiává. Hatásfokuk attól függ, hogy a bemenő energia hányad része válik hasznosíthatóvá. A gép QM hőt vesz fel a kazánból és QA hőt ad le a hűtőnek. A végzett hasznos munka: W=QM-QA A gép hatásfoka:

Kérdés: A hűtőszekrényt nem szabad szorosan a fal mellé állítani – a faltól legalább 5 cm-es távolságban kell elhelyezni. Nem célszerű éléskamrában sem üzemeltetni. Miért? Válasz: A hűtőszekrény a hűtőtérből hőt von el, és ezt környezetének adja át, tehát fűt. A fűtőhatás miatt nem ajánlatos éléskamrában tartani, és utat kell hagyni a hűtőbordákról a meleg levegő távozásának. Kérdés: A légkondicionáló berendezéseket az épületek külső falán helyezik el. Miért nem az épületen belül szerelik fel a légkondicionáló berendezéseket? Válasz: A légkondicionáló berendezés úgy működik, mint egy hűtőszekrény. Munkavégzés árán energiát von el belülről, de ennél több hőt ad át a külső környezetnek. Ha a hőt az épületen belül adná le, akkor nem hűtene, hanem fűtene!
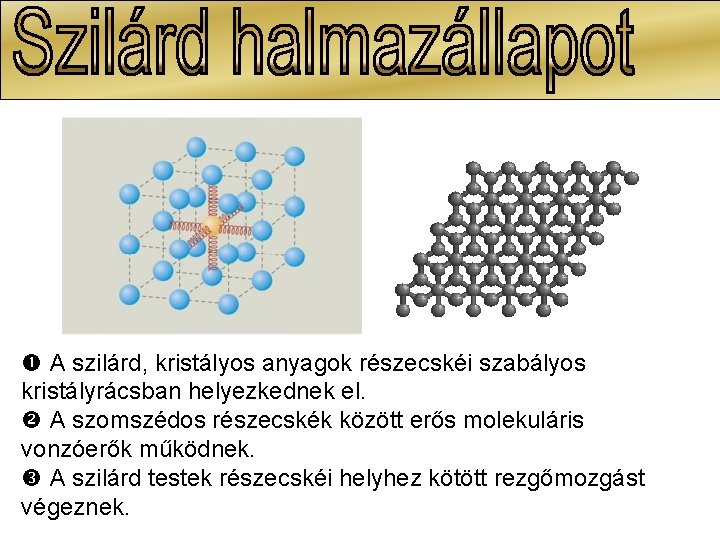
A szilárd, kristályos anyagok részecskéi szabályos kristályrácsban helyezkednek el. A szomszédos részecskék között erős molekuláris vonzóerők működnek. A szilárd testek részecskéi helyhez kötött rezgőmozgást végeznek.

Ha a szilárd testek melegítésekor a hőmérséklet eléri az olvadáspontot, akkor a részecskék egyre fokozódó rezgőmozgásának következtében a kristályrács összeomlik. A kristályos szerkezet megszűnik, a szilárd test megolvad. A test folyékony halmazállapotú lesz. A folyadékokban a részecskék között gyengébb, vonzó jellegű kohéziós erők működnek, amelyek lehetővé teszik, hogy a részecskék egymáshoz képest rendezetlenül elmozduljanak.
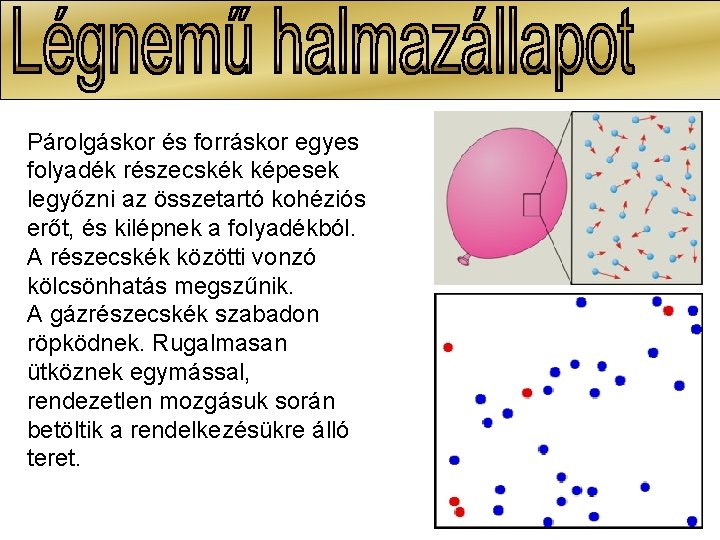
Párolgáskor és forráskor egyes folyadék részecskék képesek legyőzni az összetartó kohéziós erőt, és kilépnek a folyadékból. A részecskék közötti vonzó kölcsönhatás megszűnik. A gázrészecskék szabadon röpködnek. Rugalmasan ütköznek egymással, rendezetlen mozgásuk során betöltik a rendelkezésükre álló teret.
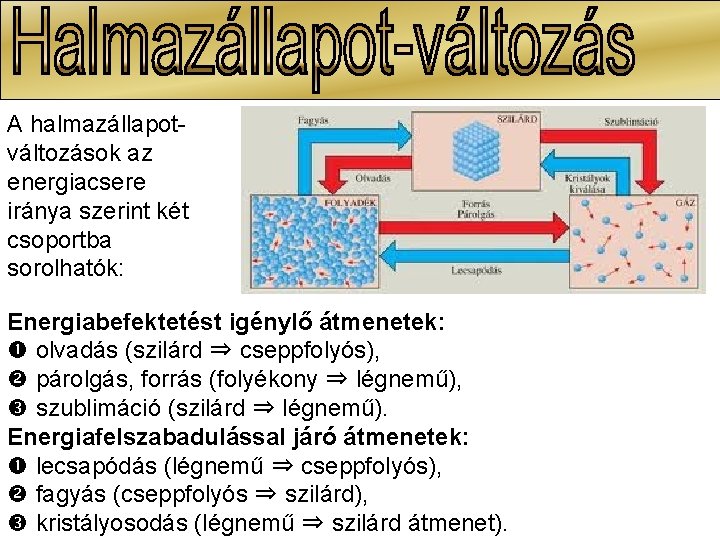
A halmazállapotváltozások az energiacsere iránya szerint két csoportba sorolhatók: Energiabefektetést igénylő átmenetek: olvadás (szilárd ⇒ cseppfolyós), párolgás, forrás (folyékony ⇒ légnemű), szublimáció (szilárd ⇒ légnemű). Energiafelszabadulással járó átmenetek: lecsapódás (légnemű ⇒ cseppfolyós), fagyás (cseppfolyós ⇒ szilárd), kristályosodás (légnemű ⇒ szilárd átmenet).
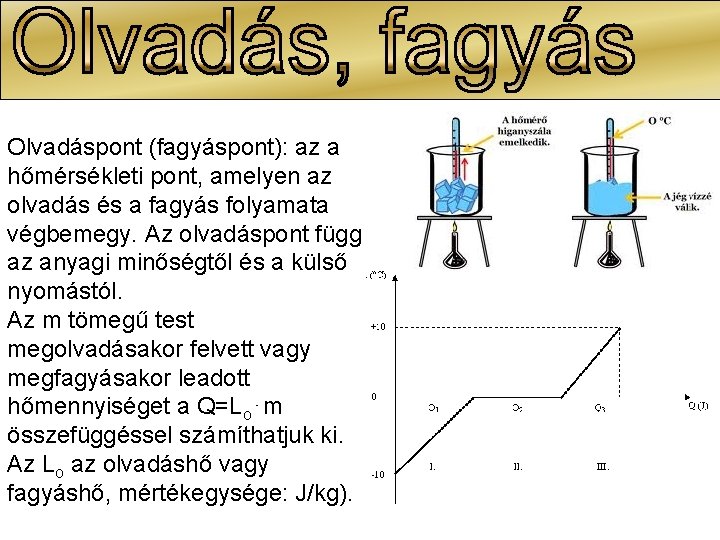
Olvadáspont (fagyáspont): az a hőmérsékleti pont, amelyen az olvadás és a fagyás folyamata végbemegy. Az olvadáspont függ az anyagi minőségtől és a külső nyomástól. Az m tömegű test megolvadásakor felvett vagy megfagyásakor leadott hőmennyiséget a Q=Lo⋅m összefüggéssel számíthatjuk ki. Az Lo az olvadáshő vagy fagyáshő, mértékegysége: J/kg).

Forráspont: az a hőmérsékleti pont, amelyen a forrás folyamata végbemegy. A forráspont függ az anyagi minőségtől és a külső nyomástól. Az m tömegű folyadék elforralásához szükséges hőmennyiséget a Q=Lf⋅m összefüggéssel számíthatjuk ki, ahol Lf a forráshő, mértékegysége: J/kg).

Kérdés: Hogyan gyorsíthatjuk meg a vizes ruha száradását? Válasz: Kiterítjük, hogy nagyobb legyen a felülete. Szabadban szárítjuk, hogy a szél elfújja a párát. Napon szárítjuk, mert melegben gyorsabban szárad. Kérdés: Miért csúszik a korcsolya a jégen és a síléc a havon? Válasz: A sítalpak és a korcsolya csúszását a csúszó felület és a hó vagy a jég között képződő vékony, megolvadt vízrétegnek köszönhetjük. A vízréteg elsősorban a súrlódásban felszabaduló hő hatására alakul ki, amit még a megnövekedett nyomás is elősegít.

56/5 Egy termoszban lévő 400 g tömegű, 25°C hőmérsékletű vízbe 100 g tömegű olvadó jeget teszünk, majd a termoszt lezárjuk. Elolvad-e a termoszban a jég? Ha nem olvad el a jég, akkor mennyi marad belőle? Ha elolvad, akkor mekkora lesz a termoszban lévő víz hőmérséklete? Számolás: Adatok: Képlet: Válasz: A jég elolvad, a termoszban 4, 05 °C hőmérsékletű víz marad.

56/6 Hőszigetelt edényben 400 g tömegű olvadó jég található. A jégre 100 g tömegű 100°C hőmérsékletű gőzt engedünk, majd az edényt lezárjuk. Termikus egyensúly kialakulása után mennyi lesz a hőmérséklet a termoszban? Adatok: Képlet: Számolás: Válasz: Az edényben 63, 6°C hőmérsékletű víz marad.

- Slides: 34