6 ACIDI E BASI 1 ACIDI E BASI

6. ACIDI E BASI

1. ACIDI E BASI SECONDO BOYLE (1660) Acidi: sostanze dal sapore aspro, capaci di corrodere i metalli, che colorano di rosso la cartina tornasole. ESEMPIO: Acidi inorganici fortemente polarizzati (HCl, HBr, HNO 3, H 2 SO 4…) Elettroliti forti Acidi inorganici e organici (acidi carbossilici) Elettroliti Basi: sostanze dal sapore amaro, saponose al tatto, che colorano di blu la cartinadeboli tornasole. ESEMPIO: Basi dei metalli alcalini e dei metalli alcalino-terrosi (Na. OH, Mg(OH)2…) Elettroliti forti Elettroliti Basi dei metalli di transizione e basi organiche (ammine) ACIDI BASI deboli Gli acidi e le basi, reagendo tra di loro, annullano le loro rispettive proprietà formando composti di natura diversa, detti sali.
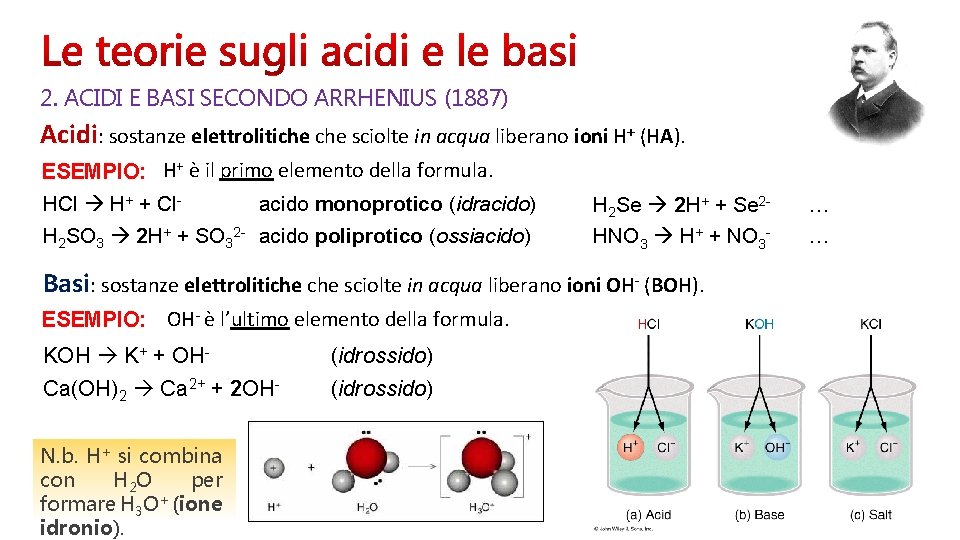
2. ACIDI E BASI SECONDO ARRHENIUS (1887) Acidi: sostanze elettrolitiche sciolte in acqua liberano ioni H+ (HA). ESEMPIO: H+ è il primo elemento della formula. HCl H+ + Clacido monoprotico (idracido) H 2 SO 3 2 H+ + SO 32 - acido poliprotico (ossiacido) H 2 Se 2 H+ + Se 2 HNO 3 H+ + NO 3 - Basi: sostanze elettrolitiche sciolte in acqua liberano ioni OH- (BOH). ESEMPIO: OH- è l’ultimo elemento della formula. KOH K+ + OHCa(OH)2 Ca 2+ + 2 OHN. b. H+ si combina con H 2 O per formare H 3 O+ (ione idronio). (idrossido) … …
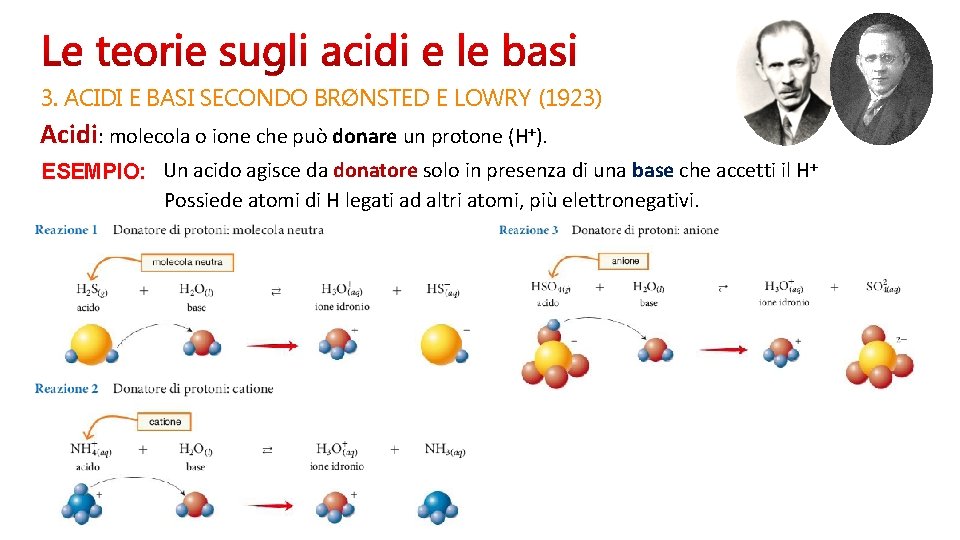
3. ACIDI E BASI SECONDO BRØNSTED E LOWRY (1923) Acidi: molecola o ione che può donare un protone (H+). ESEMPIO: Un acido agisce da donatore solo in presenza di una base che accetti il H+ Possiede atomi di H legati ad altri atomi, più elettronegativi.
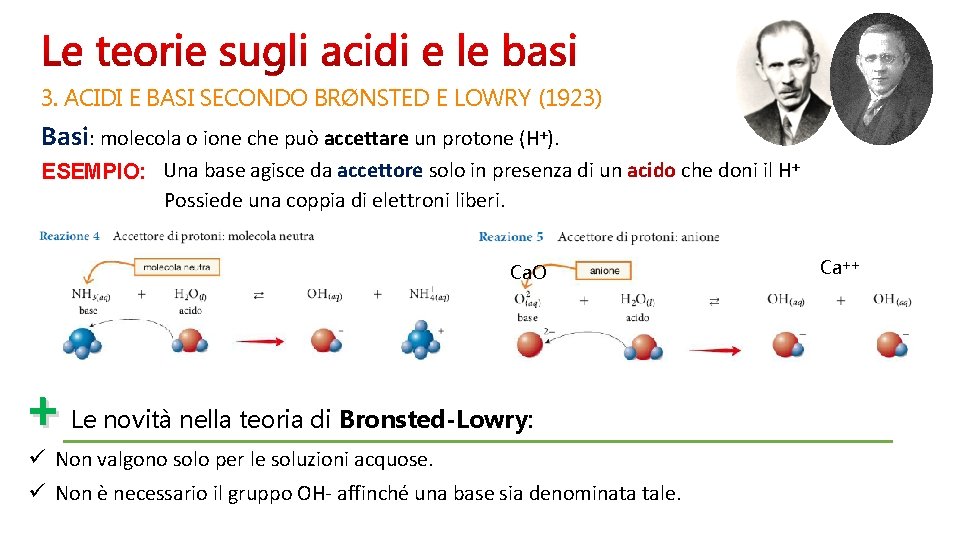
3. ACIDI E BASI SECONDO BRØNSTED E LOWRY (1923) Basi: molecola o ione che può accettare un protone (H+). ESEMPIO: Una base agisce da accettore solo in presenza di un acido che doni il H+ Possiede una coppia di elettroni liberi. Ca. O + Le novità nella teoria di Bronsted-Lowry: ü Non valgono solo per le soluzioni acquose. ü Non è necessario il gruppo OH- affinché una base sia denominata tale. Ca++
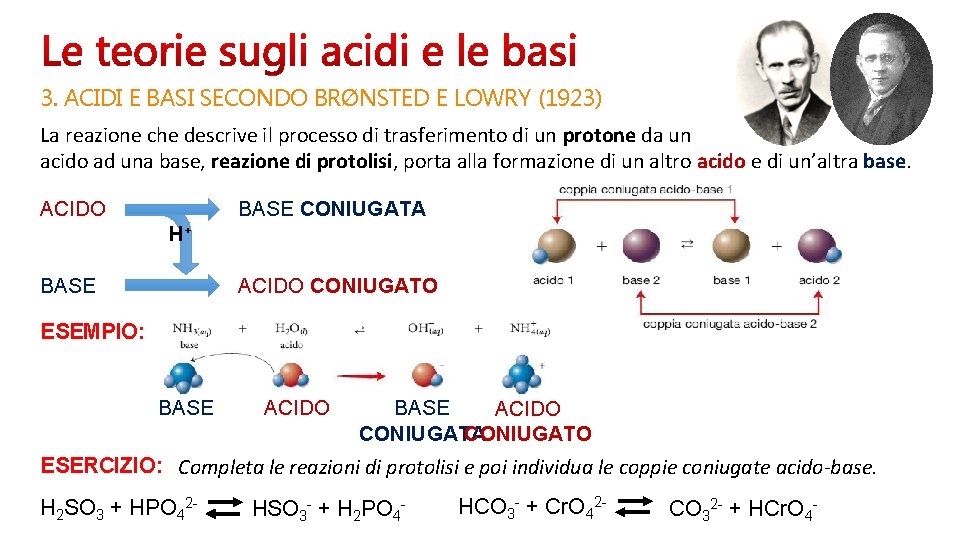
3. ACIDI E BASI SECONDO BRØNSTED E LOWRY (1923) La reazione che descrive il processo di trasferimento di un protone da un acido ad una base, reazione di protolisi, porta alla formazione di un altro acido e di un’altra base. BASE CONIUGATA ACIDO H+ ACIDO CONIUGATO BASE ESEMPIO: BASE ACIDO CONIUGATA CONIUGATO ESERCIZIO: Completa le reazioni di protolisi e poi individua le coppie coniugate acido-base. H 2 SO 3 + HPO 42 - HSO 3 - + H 2 PO 4 - HCO 3 - + Cr. O 42 - CO 32 - + HCr. O 4 -
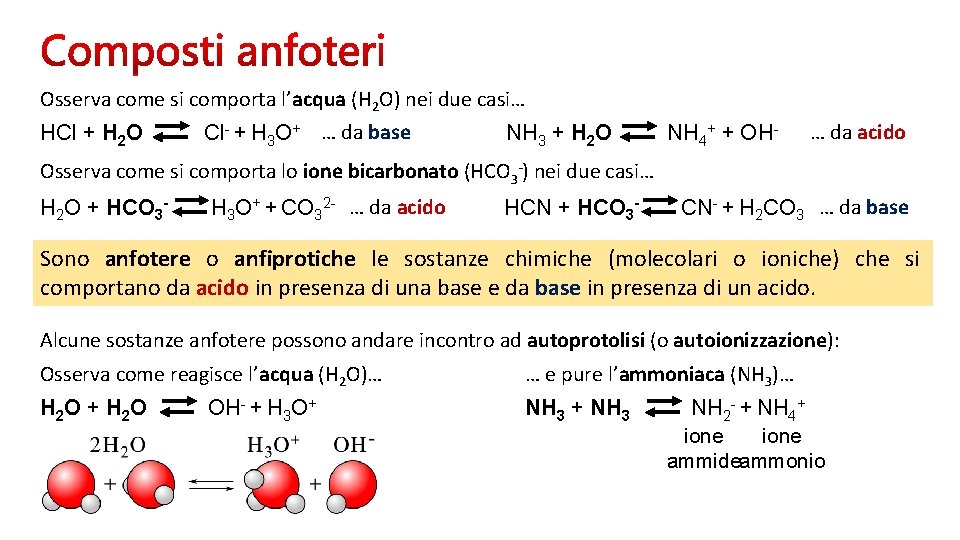
Osserva come si comporta l’acqua (H 2 O) nei due casi… HCl + H 2 O Cl- + H 3 O+ … da base NH 3 + H 2 O NH 4+ + OH- … da acido Osserva come si comporta lo ione bicarbonato (HCO 3 -) nei due casi… H 2 O + HCO 3 - H 3 O+ + CO 32 - … da acido HCN + HCO 3 - CN- + H 2 CO 3 … da base Sono anfotere o anfiprotiche le sostanze chimiche (molecolari o ioniche) che si comportano da acido in presenza di una base e da base in presenza di un acido. Alcune sostanze anfotere possono andare incontro ad autoprotolisi (o autoionizzazione): Osserva come reagisce l’acqua (H 2 O)… … e pure l’ammoniaca (NH 3)… H 2 O + H 2 O NH 3 + NH 3 OH- + H 3 O+ NH 2 - + NH 4+ ione ammideammonio

4. ACIDI E BASI DI LEWIS (1923) Acidi: molecola o ione che può accettare una coppia di elettroni. Basi: molecola o ione che può donare una coppia di elettroni liberi da legame. Acidi e basi di Lewis si uniscono per formare complessi (complessi di coordinazione o ioni complessi). ESEMPIO: Acidi e basi secondo Bronsted-Lowry sono pure acidi e basi di Lewis. BRONSTED- HCl + H 2 O LOWRY B 1 A 1 Cl- + H 3 O+ B 2 A 2 LEWIS H+ + Cl- + H 2 O H 3 O+ + Cl- A B COMPLESS dei metalli di ESEMPIO: Sono acidi di Lewis le molecole con ottetti incompleti e i cationi O transizione e del terzo gruppo, sono basi le sostanze con coppie di e- non condivisi. + Cl- B A COMPLESS A B Al. Cl 4– COMPLESS O
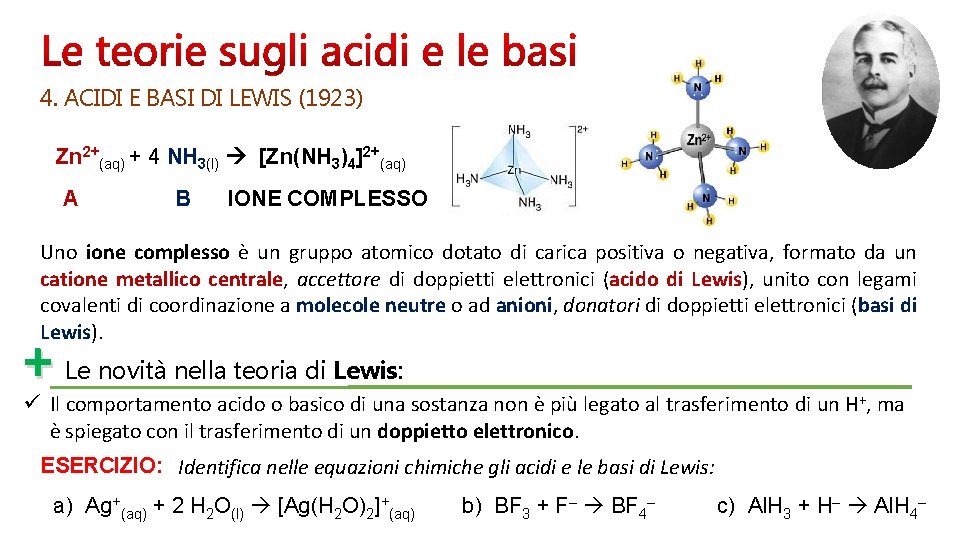
4. ACIDI E BASI DI LEWIS (1923) Zn 2+(aq) + 4 NH 3(l) [Zn(NH 3)4]2+(aq) A B IONE COMPLESSO Uno ione complesso è un gruppo atomico dotato di carica positiva o negativa, formato da un catione metallico centrale, accettore di doppietti elettronici (acido di Lewis), unito con legami covalenti di coordinazione a molecole neutre o ad anioni, donatori di doppietti elettronici (basi di Lewis). + Le novità nella teoria di Lewis: ü Il comportamento acido o basico di una sostanza non è più legato al trasferimento di un H+, ma è spiegato con il trasferimento di un doppietto elettronico. ESERCIZIO: Identifica nelle equazioni chimiche gli acidi e le basi di Lewis: a) Ag+(aq) + 2 H 2 O(l) [Ag(H 2 O)2]+(aq) b) BF 3 + F– BF 4– c) Al. H 3 + H– Al. H 4–

L’acqua è un elettrolita debolissimo perché ha una ridottissima conducibilità elettrica. Da cosa deriva questa proprietà? H 2 O + H 2 O OH– + H 3 O+ N. b. l’equilibrio di autoionizzazione (autoprotolisi) è molto spostato verso sinistra (frecce asimmetriche). Da misurazioni sperimentali sull’acqua pura a 25 °C, risulta che, all’equilibrio: [OH–] = [H 3 O+] = 1, 00 ⋅ 10– 7 M La costante di equilibrio per l’acqua è definita come: 2 H 2 O OH– + H 3 O+ = Kw Quindi… Questa espressione rappresenta il prodotto ionico dell’acqua.

Kw • Poiché la reazione di autoionizzazione è endotermica (ΔH > 0), all’aumentare della temperatura, Kw aumenta. ESEMPIO: Ecco cosa succede quando sciogliamo un acido in acqua: Come determinare quando una soluzione è acida oppure basica?

…corrisponde all’esponente cambiato di segno Come passare da p. OH a p. H e viceversa? p. H + p. OH = 14 • p. H = 14 - p. OH • p. OH = 14 - p. H
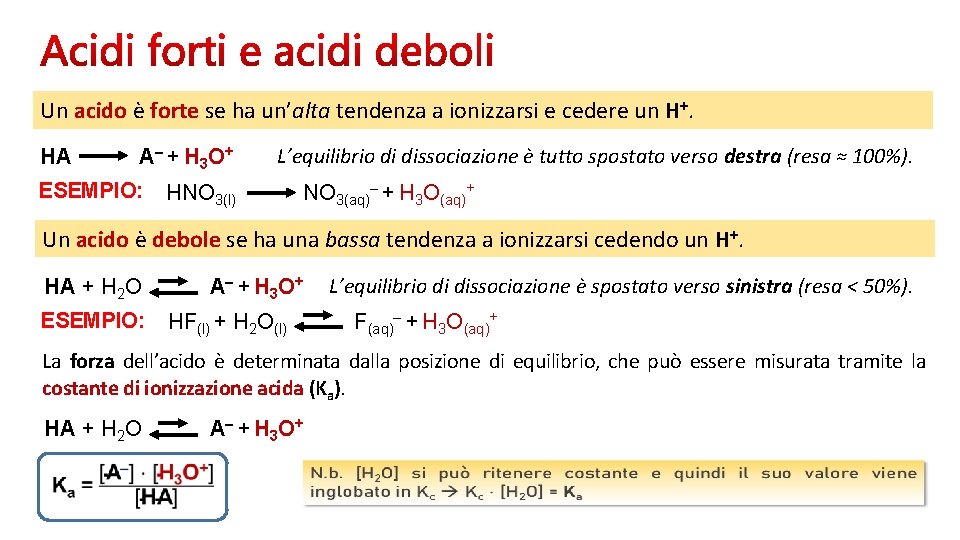
Un acido è forte se ha un’alta tendenza a ionizzarsi e cedere un H+. HA A – + H 3 O + ESEMPIO: L’equilibrio di dissociazione è tutto spostato verso destra (resa ≈ 100%). HNO 3(l) NO 3(aq)– + H 3 O(aq)+ Un acido è debole se ha una bassa tendenza a ionizzarsi cedendo un H+. HA + H 2 O ESEMPIO: A – + H 3 O + HF(l) + H 2 O(l) L’equilibrio di dissociazione è spostato verso sinistra (resa < 50%). F(aq)– + H 3 O(aq)+ La forza dell’acido è determinata dalla posizione di equilibrio, che può essere misurata tramite la costante di ionizzazione acida (Ka). HA + H 2 O A – + H 3 O +
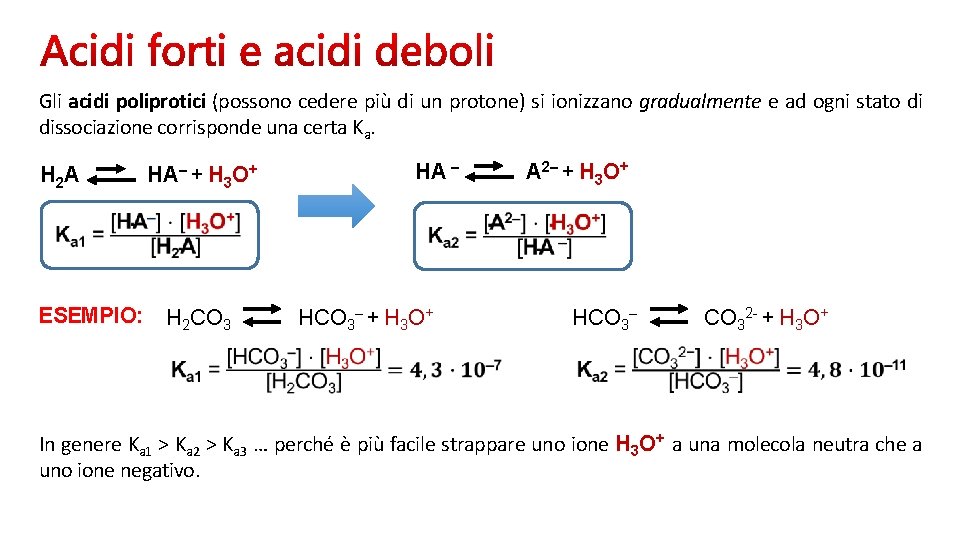
Gli acidi poliprotici (possono cedere più di un protone) si ionizzano gradualmente e ad ogni stato di dissociazione corrisponde una certa Ka. H 2 A ESEMPIO: HA– + H 3 O+ H 2 CO 3 HA – HCO 3– + H 3 O+ A 2– + H 3 O+ HCO 3– CO 32 - + H 3 O+ In genere Ka 1 > Ka 2 > Ka 3 … perché è più facile strappare uno ione H 3 O+ a una molecola neutra che a uno ione negativo.
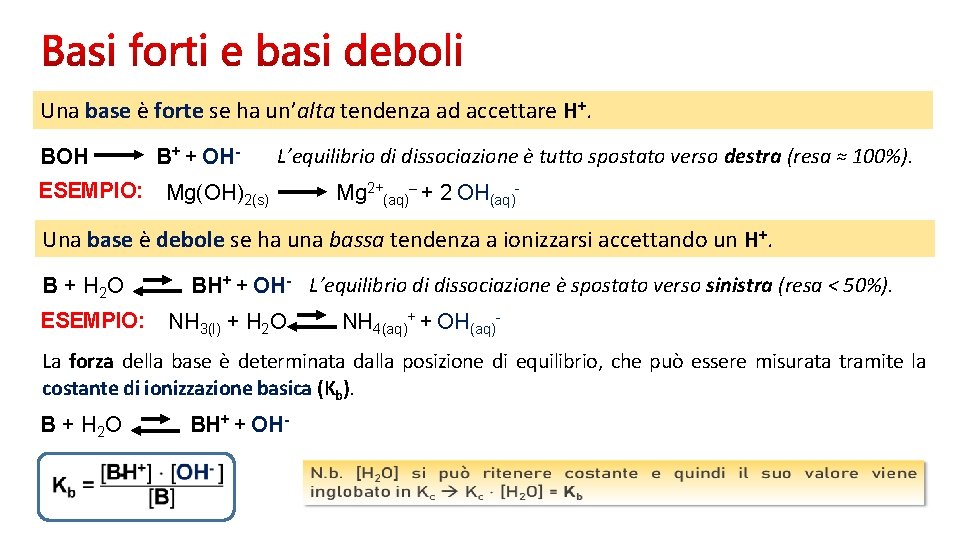
Una base è forte se ha un’alta tendenza ad accettare H+. BOH ESEMPIO: B+ + OH- L’equilibrio di dissociazione è tutto spostato verso destra (resa ≈ 100%). Mg(OH)2(s) Mg 2+(aq)– + 2 OH(aq)- Una base è debole se ha una bassa tendenza a ionizzarsi accettando un H+. B + H 2 O ESEMPIO: BH+ + OH- L’equilibrio di dissociazione è spostato verso sinistra (resa < 50%). NH 3(l) + H 2 O NH 4(aq)+ + OH(aq)- La forza della base è determinata dalla posizione di equilibrio, che può essere misurata tramite la costante di ionizzazione basica (Kb). B + H 2 O BH+ + OH-
![ACIDI FORTI Sono completamente ionizzati in soluzione. ESEMPIO: HCl H+ + Cldove [H+] = ACIDI FORTI Sono completamente ionizzati in soluzione. ESEMPIO: HCl H+ + Cldove [H+] =](http://slidetodoc.com/presentation_image_h2/630ddc016d197dda9bdbad95799dcb27/image-16.jpg)
ACIDI FORTI Sono completamente ionizzati in soluzione. ESEMPIO: HCl H+ + Cldove [H+] = [HCl] BASI FORTI Sono completamente dissociate in soluzione. ESEMPIO: Ca(OH)2 2 OH- + Ca 2+ ESERCIZIO: Calcola il p. H di un soluzione di acido bromidrico per la quale [HBr] è uguale a 3, 6 x 10 -4 M. Qual è la concentrazione iniziale dell’acido?

ACIDI DEBOLI Sono parzialmente ionizzati in soluzione. HA + H 2 O A – + H 3 O + Ora posso ricavare il p. H… N. b. per calcolare il p. OH di una base debole si procede allo stesso modo.
- Slides: 17