4 Damtma ile ayrmalar iki veya daha fazla

















- Slides: 30

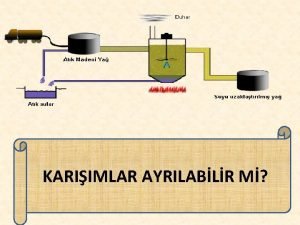
4 -Damıtma ile ayırmalar iki veya daha fazla bileşen içeren bir karışımın ısıtılıp, buhar ve sıvı faz oluşturmak suretiyle daha uçucu bileşence zengin karışımların elde edilmesini sağlayan ayırma işlemidir. A+ B Karışımında Damıtma sırasında, buhar faz daha uçucu olan A bileşeni tarafından zenginleşirken, sıvı faz ise kaynama sıcaklığı daha yüksek olan B bileşenince zenginleşir. Fakat yüzde 100 A içeren bir buhar faz elde edilemez.

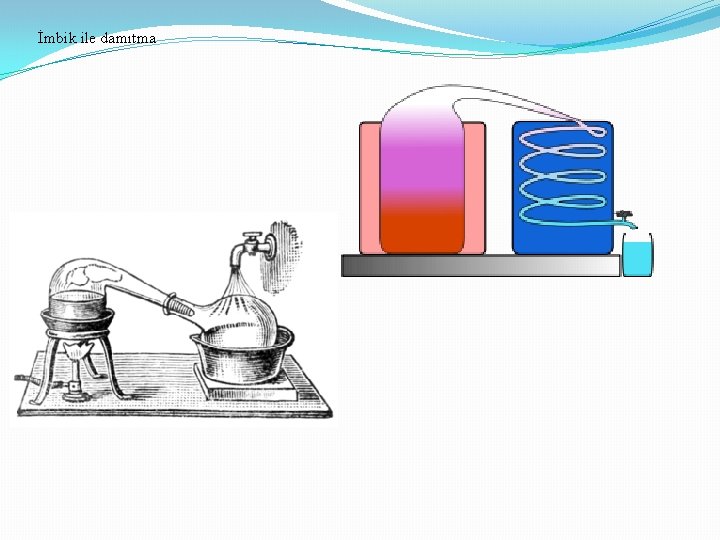
İmbik ile damıtma

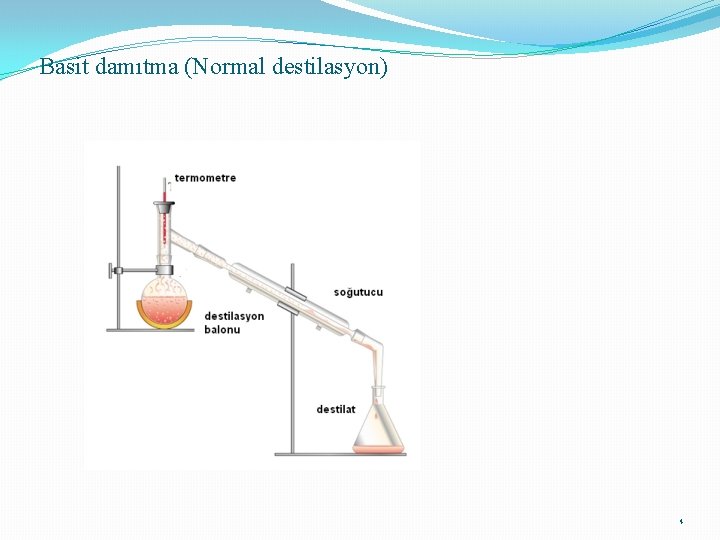
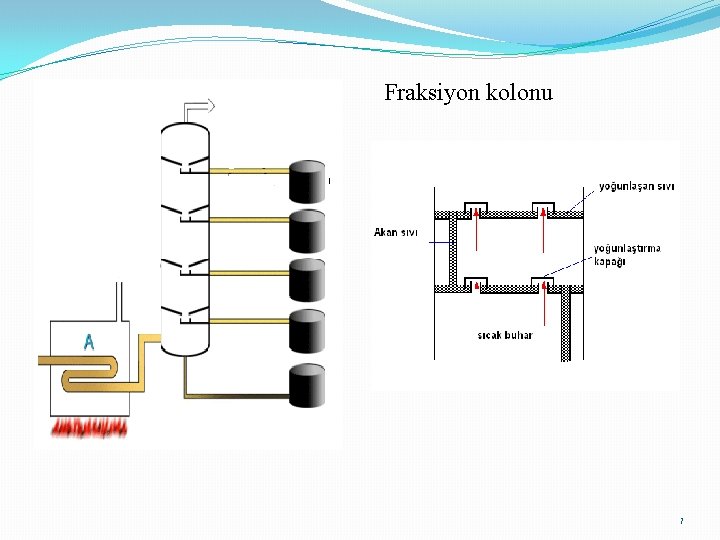
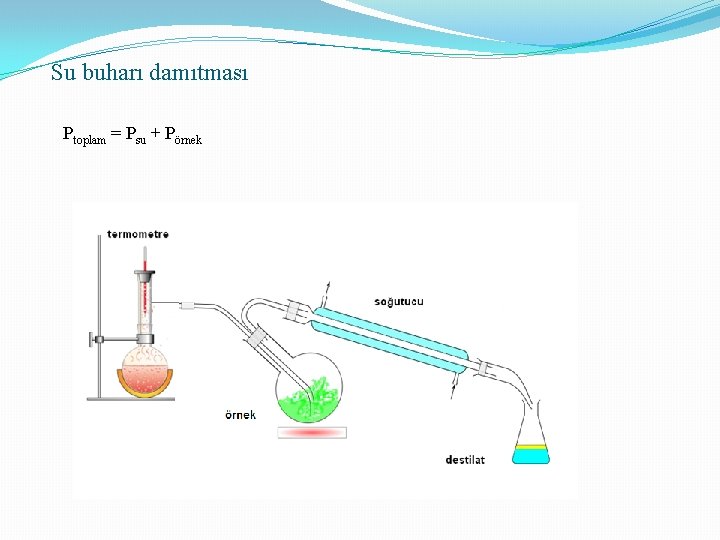
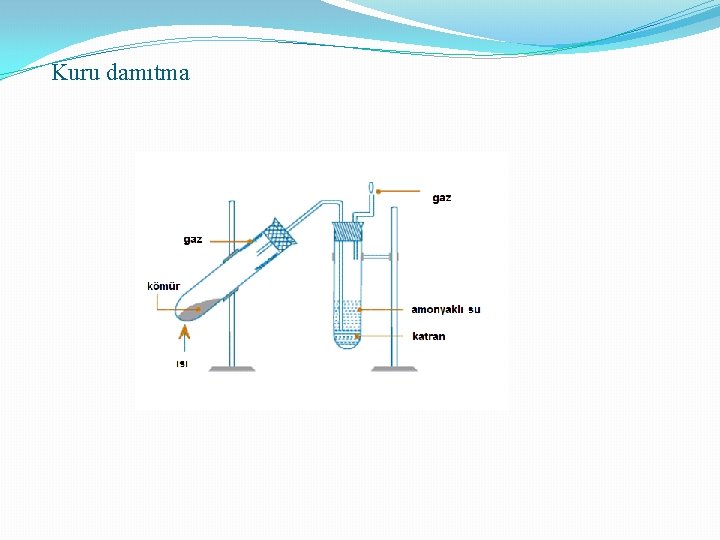
Damıtma ve damıtma çeşitleri 1. Basit Damıtma: Uçucu olmayan maddeler içeren bir sıvının ısıtılması ve buharlarının yoğunlaştırılarak ayrılması Kaynama noktaları çok farklı olan sıvıların ısıtılması ve ayrılması 2. Çok Aşamalı Buharlaştırma: (Fraksiyonlu) normal damıtma düzeneğine fraksiyon kolonu eklenmesi ile oluşur 3. Buhar Damıtması: (su buharı): Ayrılacak karışıma buhar gönderilir ve buharla birlikte sürüklenir. Damıtma, normal kaynama noktasından küçük sıcaklıklarda gerçekleşir. 4. Kuru Damıtma: Katı-Sıvı-Gaz halinde ürünler veren organik cisimlerin havasız bir yerde ısıtılarak parçalanması işlemidir. (taş kömürünün damıtılması) 3

Basit damıtma (Normal destilasyon) 4

Fraksiyonlu damıtma 5


Fraksiyon kolonu 7

Su buharı damıtması Ptoplam = Psu + Pörnek

Kuru damıtma

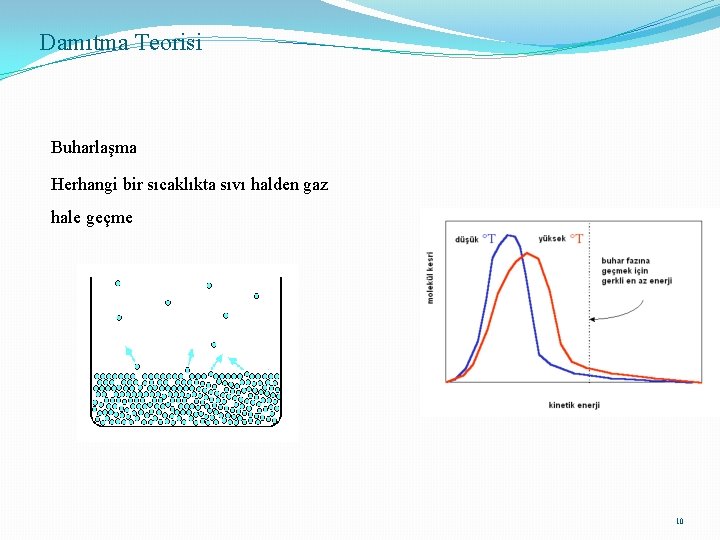
Damıtma Teorisi Buharlaşma Herhangi bir sıcaklıkta sıvı halden gaz hale geçme 10

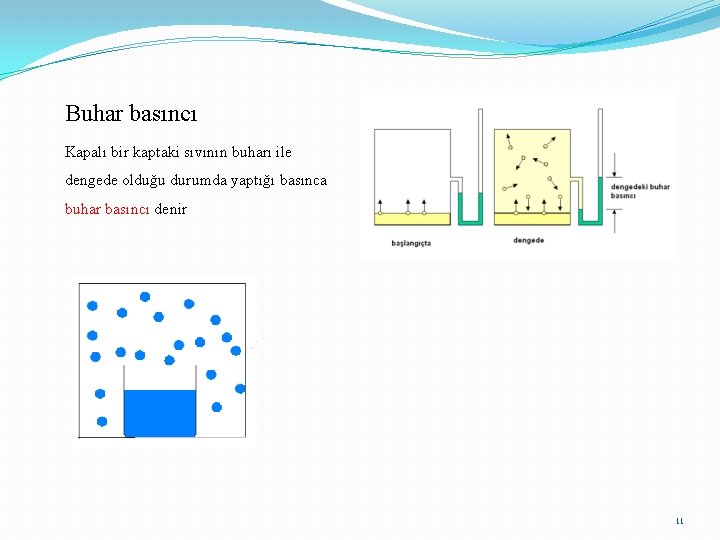
Buhar basıncı Kapalı bir kaptaki sıvının buharı ile dengede olduğu durumda yaptığı basınca buhar basıncı denir 11

Çözeltilerde Buharlaşma: 12

Çözeltilerin buhar basınçları (Raoult Kanunu) Bir çözeltideki ucu bir maddenin buhar basıncı o maddenin çözeltideki mol kesri ve saf haldeki buhar basıncı ile doğru orantılıdır. PA = X A POA PB = X B POB PÇözelti = PA + PB PÇözelti = X A POA + X B POB 13

Örnek : Benzen ve Toluenin mol kesirleri 0, 5 olan çözeltide benzenin ve toluenin buhar basıncı nedir? Pobenzen= 95, 1 torr, Po. Toluen= 28, 4 mm. Hg dir. Pben = 0, 5 x 95, 1 = 47, 6 mm. Hg PTo l= 0, 5 x 28, 4 = 14, 2 mm. Hg PTop= 47, 6 + 14, 2 = 61, 8 mm. Hg 14

Çözeltilerin buhar fazında gaz kanunları geçerlidir. Buhar bileşimi: Dalton kısmi basınçlar kanunu’ndan PT = PA + PB ve X’ buhar fazındaki mol kesri olmak üzere PA = X’A PT PB = X’B PT X’A = PA / PT 15

Biraz önceki örnekteki buhar bileşimi; Xben = 0, 5 Xtol = 0, 5 PT = Pben + Ptol PT = 47, 6 + 14, 2 X’ben = Pben / PT = 47, 6 / 61, 8 = 0, 77 X’tol = Ptol / PT = 14, 2 / 61, 8 = 0, 23 16

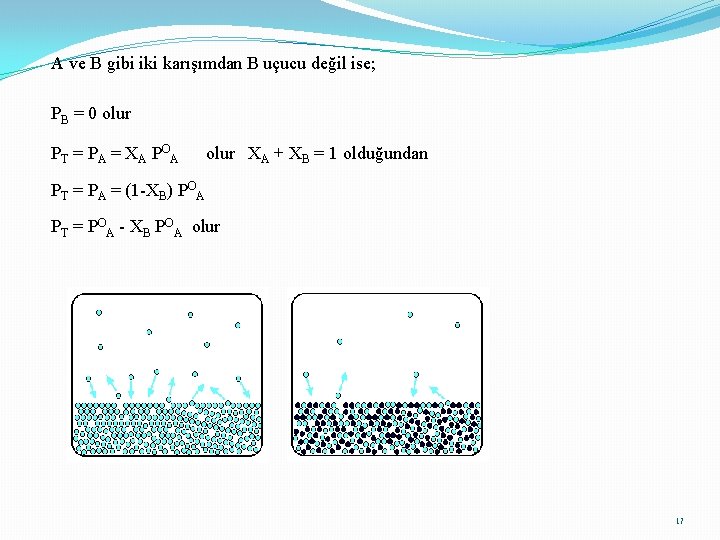
A ve B gibi iki karışımdan B uçucu değil ise; PB = 0 olur PT = PA = XA POA olur XA + XB = 1 olduğundan PT = PA = (1 -XB) POA PT = POA - XB POA olur 17

Örnek Sıcaklık 300 K iken 1 ve 2 sıvılarının saf haldeki buhar basınçları sırayla 200 mm. Hg ve 500 mm. Hg’dır. Aynı sıcaklıkta karışımın toplam buhar basıncı 350 mm. Hg olduğuna göre sıvı ve buhar fazının bileşimlerini hesaplayınız. Çözüm: PT = P 1 + P 2 PT = Po 1 X 1 + Po 2 X 2 PT = Po 1 X 1 + Po 2(1 -X 1) 350 mm. Hg = 200 mm. Hg X 1 + 500 mm. Hg (1 -X 1) X 1 =0, 5 X 2= 1 - 0, 5 = 0, 5 (sıvı fazı bileşimi) y 1 = p 1 /p. T = X 1 p 0 / p. T = 0, 50 x 200 mm. Hg / 350 mm. Hg y 1 = 0, 28 y 2 = 0, 78 18

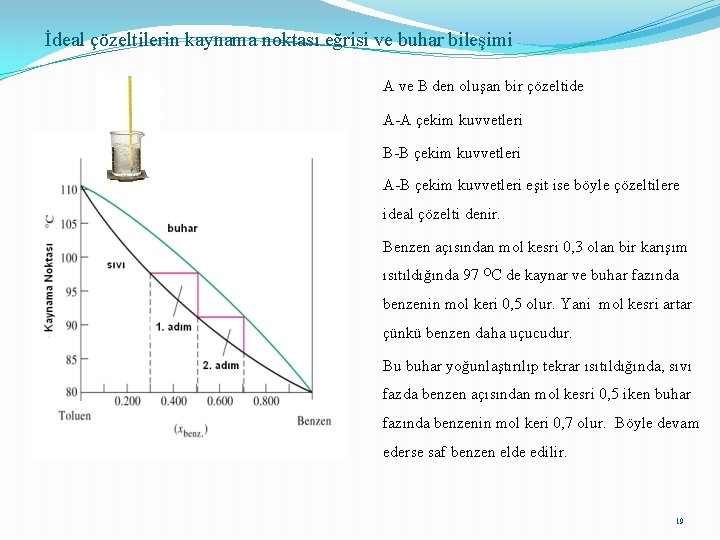
İdeal çözeltilerin kaynama noktası eğrisi ve buhar bileşimi A ve B den oluşan bir çözeltide A-A çekim kuvvetleri B-B çekim kuvvetleri A-B çekim kuvvetleri eşit ise böyle çözeltilere ideal çözelti denir. Benzen açısından mol kesri 0, 3 olan bir karışım ısıtıldığında 97 OC de kaynar ve buhar fazında benzenin mol keri 0, 5 olur. Yani mol kesri artar çünkü benzen daha uçucudur. Bu buhar yoğunlaştırılıp tekrar ısıtıldığında, sıvı fazda benzen açısından mol kesri 0, 5 iken buhar fazında benzenin mol keri 0, 7 olur. Böyle devam ederse saf benzen elde edilir. 19

Damıtma ile sıvılar nasıl ayrılır? Örnek : Benzen ve toluenin buhar basıncı sırasıyla 753 ve 290 mm. Hg dir. Mol kesri 0. 5 olan benzen ve toluen karışımı 1, 2, 3 defa damıtılırsa destilat bileşimi ne olur? POben = 753 mm. Hg POtol = 290 mm. Hg Xtol = 0, 5 Pben = Xben POben Ptol = Xtol POtol PT = Pben + Ptol PT = Xben POben + Xtol POtol PT = 0, 5 x 753 mm. Hg + 0, 5 x 290 mm. Hg PT = 376 + 145 PT = 521 mm. Hg 20

Gaz fazı bileşimi Dalton kanunundan; Pi = X'i PT X'i = Pi / PT X'ben = 376 / 521 = 0, 72 X'tol = 145 / 521 = 0, 28 21

İkinci damıtmada; Xben = 0, 72 Xtol = 0, 28 3. Damıtmada; X'ben = 0, 95 X'tol = 0, 05 PT = Pben + Ptol PT = Xben POben + Xtol POtol PT = 0, 72 x 753 mm. Hg + 0, 28 x 290 mm. Hg PT = 542, 1 + 81, 2= 623, 3 mm. Hg Gaz fazı bileşimi Dalton kanunundan; Pi = X'i PT X'i = Pi / PT X'ben = 542, 1 / 623, 3 = 0, 87 X'tol = 81, 2 / 623, 3 = 0, 13 22

A ve B gibi ikili karışımın fraksiyonlu destilasyonunda; α = POA / POB olmak üzere (Uçucu(büyük) / az uçucu(küçük)) XAn / 1 - XAn = αn(XA / 1 - XA) eşitliği vardır α : bağıl buharlaşma XAn : n damıtma sonucu destilatın mol kesri XA: Başlangıçtaki çözeltideki mol kesri 23

Örnek Soru : 138 OC de % 25 (mol yüzdesi) p-ksilen ve o-ksilen karışımını % 99, 9 luk yapmak için kaç defa destile edilmelidir? Veya fraksiyon kolonunda kaç tabaka olmalıdır? POp-ksilen = 760 mm. Hg POo-ksilen = 637 mm. Hg XAn / 1 - XAn = αn(XA / 1 - XA) 0, 999 / 1 - 0, 999 = (760/637) n (0, 25 / 1 - 0, 25) 999 = (1, 19) n 0, 333 3000 = 1, 19 n log 3000 = log 1, 19 n log 3000 = nlog 1, 19 3, 47 = n 0, 075 n = 46 damıtma 24

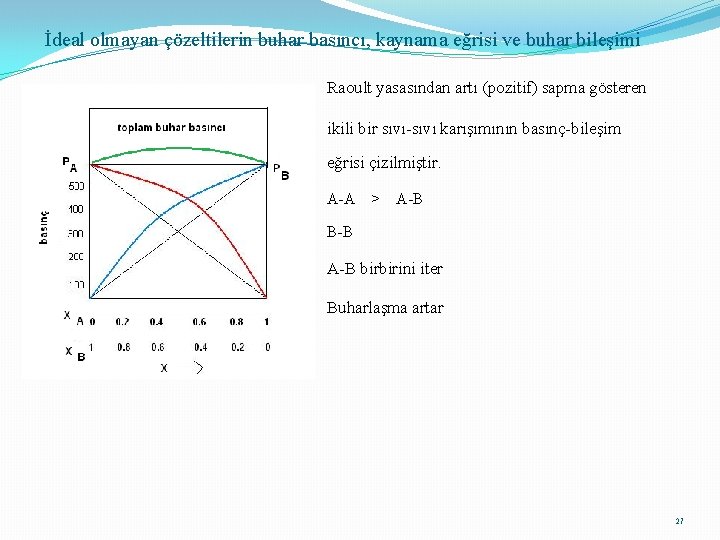
Raoult Yasasından Sapmalar Bazı çözeltiler Raoult yasasından artı bazıları ise eksi sapmalar gösterirler. İdeal çözeltilerde, A-A = A-B B-B Karışma sırasında ısı alışverişi olmaz Hacim değişimi gözlenmez. Buhar basıncı değişmez Raoult yasasından pozitif (artı) sapma; A-A > A-B B-B A ve B moleküllerinin birbirini iter. Karışma dışarıdan ısı alınır (karışma endotermiktir). Hacim büyür. Buhar basıncı artar 25

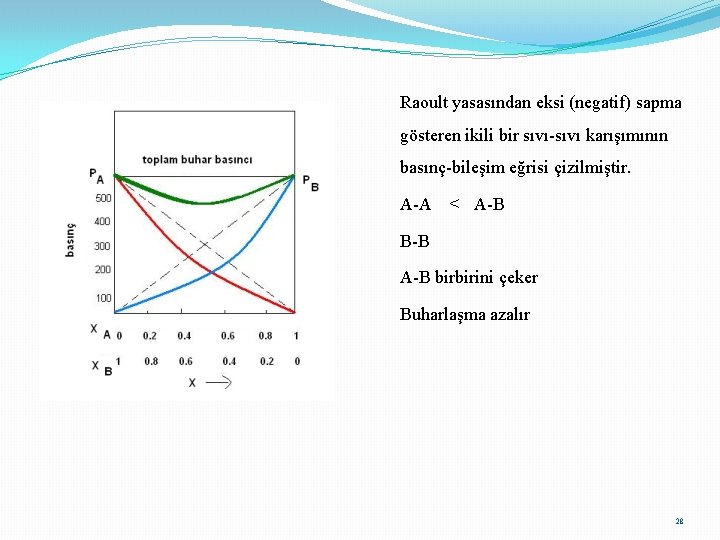
Raoult yasasından negatif (eksi) sapma; A-A < A-B B-B A ve B moleküllerinin birbirini çeker. Karışma dışarı ısı verir (karışma ekzotermik). Hacim küçülür. Buhar basıncı azalır

İdeal olmayan çözeltilerin buhar basıncı, kaynama eğrisi ve buhar bileşimi Raoult yasasından artı (pozitif) sapma gösteren ikili bir sıvı-sıvı karışımının basınç-bileşim eğrisi çizilmiştir. A-A > A-B B-B A-B birbirini iter Buharlaşma artar 27

Raoult yasasından eksi (negatif) sapma gösteren ikili bir sıvı-sıvı karışımının basınç-bileşim eğrisi çizilmiştir. A-A < A-B B-B A-B birbirini çeker Buharlaşma azalır 28

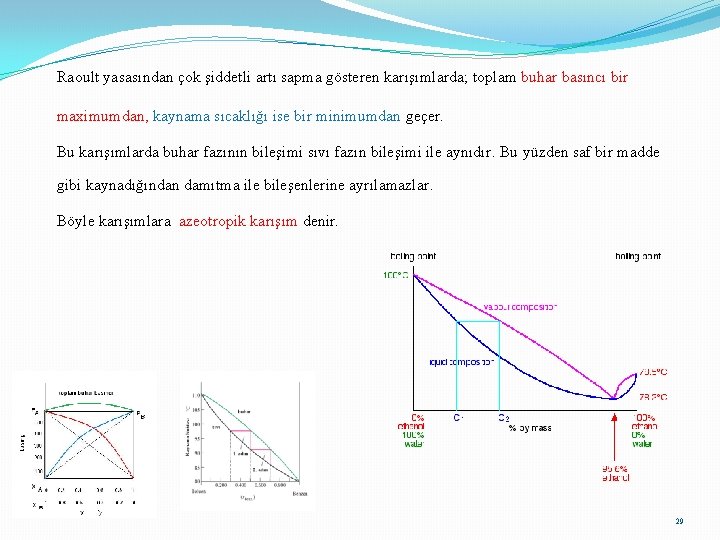
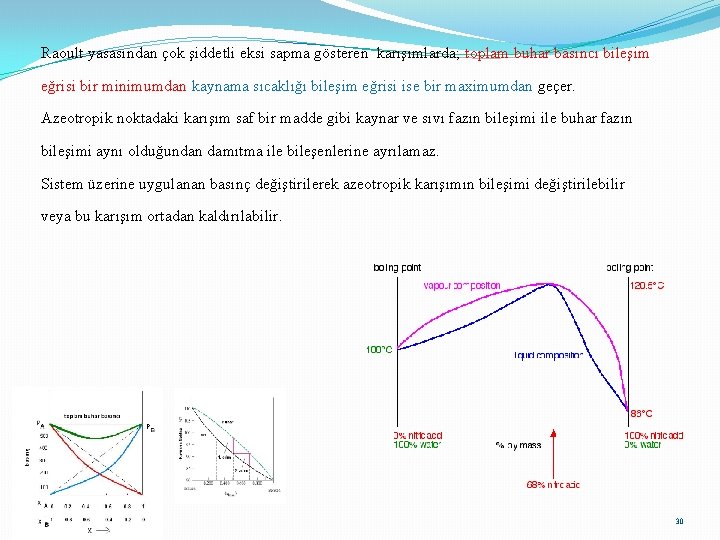
Raoult yasasından çok şiddetli artı sapma gösteren karışımlarda; toplam buhar basıncı bir maximumdan, kaynama sıcaklığı ise bir minimumdan geçer. Bu karışımlarda buhar fazının bileşimi sıvı fazın bileşimi ile aynıdır. Bu yüzden saf bir madde gibi kaynadığından damıtma ile bileşenlerine ayrılamazlar. Böyle karışımlara azeotropik karışım denir. 29

Raoult yasasından çok şiddetli eksi sapma gösteren karışımlarda; toplam buhar basıncı bileşim eğrisi bir minimumdan kaynama sıcaklığı bileşim eğrisi ise bir maximumdan geçer. Azeotropik noktadaki karışım saf bir madde gibi kaynar ve sıvı fazın bileşimi ile buhar fazın bileşimi aynı olduğundan damıtma ile bileşenlerine ayrılamaz. Sistem üzerine uygulanan basınç değiştirilerek azeotropik karışımın bileşimi değiştirilebilir veya bu karışım ortadan kaldırılabilir. 30
 üleştirme sayılarının yazımı
üleştirme sayılarının yazımı Bir kat iki daireli zil tesisatı
Bir kat iki daireli zil tesisatı Iki buton iki zil tesisatı
Iki buton iki zil tesisatı Büyük ve küçük çapı bilinen oval çizmek
Büyük ve küçük çapı bilinen oval çizmek Sünnimärkide uuring
Sünnimärkide uuring Gereğinden az genelleme örnekleri
Gereğinden az genelleme örnekleri Empati sözleri
Empati sözleri Atlye
Atlye Peritübüler kapiller
Peritübüler kapiller Harflerin simetrisi
Harflerin simetrisi Bir modeme en fazla kaç kişi bağlanabilir
Bir modeme en fazla kaç kişi bağlanabilir Karl gross oyun kuramı
Karl gross oyun kuramı Izodizomi
Izodizomi özünü yineleme kuramı
özünü yineleme kuramı Yardang nedir
Yardang nedir Matris örnekleri
Matris örnekleri Samimiyet sözleri
Samimiyet sözleri Parenteral beslenme çeşitleri
Parenteral beslenme çeşitleri Bu konuyu bir daha açmayacağım
Bu konuyu bir daha açmayacağım Daha dün annemizin notaları
Daha dün annemizin notaları Dal yaprak grafiği hesaplama
Dal yaprak grafiği hesaplama Kirmizi isik kirmizi filtre
Kirmizi isik kirmizi filtre Ay ne bicimdedir
Ay ne bicimdedir Senden bir tane daha yok
Senden bir tane daha yok Den daha az sıklıkları bulma
Den daha az sıklıkları bulma Daha iyiye en ileriye
Daha iyiye en ileriye Nota değerleri ve vuruşları
Nota değerleri ve vuruşları Bir pist veya alanda yapılan
Bir pist veya alanda yapılan Kulak koruyucularının ambalaj üzerinde nrr veya snr
Kulak koruyucularının ambalaj üzerinde nrr veya snr Lgl kolesterol
Lgl kolesterol Selami turhan
Selami turhan