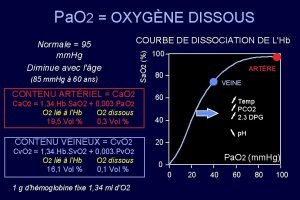
3 Cintique des gaz et arosols 1 2



![Pression et température m = masse d’une molécule n = concentration en molécules [m-3] Pression et température m = masse d’une molécule n = concentration en molécules [m-3]](https://slidetodoc.com/presentation_image/0054bf85159a8ecb00a9a59a14f631c6/image-4.jpg)
![Libre parcours moyen n Molécule de diamètre d. n = concentration en molécules [m-3] Libre parcours moyen n Molécule de diamètre d. n = concentration en molécules [m-3]](https://slidetodoc.com/presentation_image/0054bf85159a8ecb00a9a59a14f631c6/image-5.jpg)



















- Slides: 25

3. Cinétique des gaz et aérosols 1. 2. Rappels et définitions Milieu constitué de 2 espèces

Vitesses Vitesse la plus probable Vp (équilibre de Boltzmann) n Vitesse moyenne : n n Vitesse quadratique moyenne :

Flux n C’est le nombre de molécules qui traversent à l’équilibre l’unité de surface par unité de temps. n = concentration en molécules [L-3]
![Pression et température m masse dune molécule n concentration en molécules m3 Pression et température m = masse d’une molécule n = concentration en molécules [m-3]](https://slidetodoc.com/presentation_image/0054bf85159a8ecb00a9a59a14f631c6/image-4.jpg)
Pression et température m = masse d’une molécule n = concentration en molécules [m-3] k = constante de Boltzmann 1, 380× 10 -23 J. K-1
![Libre parcours moyen n Molécule de diamètre d n concentration en molécules m3 Libre parcours moyen n Molécule de diamètre d. n = concentration en molécules [m-3]](https://slidetodoc.com/presentation_image/0054bf85159a8ecb00a9a59a14f631c6/image-5.jpg)
Libre parcours moyen n Molécule de diamètre d. n = concentration en molécules [m-3]

Libre parcours moyen pour un gaz S = constante de Sutherland P en k. Pa T en K 760 mm Hg = 1 atm = 1, 013× 105 Pa

Viscosité dynamique d’un gaz (Pa. s) 1 micropoise = 10 -7 Pa. s m = masse d’une molécule n = concentration en molécules [m-3]

3. Cinétique des gaz et aérosols 1. 2. Rappels et définitions Milieu constitué de 2 espèces

n n n 2 espèces (molécules ou molécules-particules) assimilables à des sphères rigides, sans interactions à distance. Température identique en tout point du système. Chocs élastiques n 1 et n 2 sont les concentrations respectives de chaque espèce m 1 et m 2 sont les masses respectives de chaque espèce

Libre parcours moyen

Cas d’un aérosol n Si n 2 << n 1 et m 2 >> m 1 (cas d’une particule dans un gaz) d 12 rayon de la particule

Coefficient de diffusion n n 1 et n 2 : concentrations indépendantes de t La répartition est uniforme dans chaque plan // au plan xy n La diffusion se fait // à z n Equilibre de T et P dans tout le volume considéré. n

n n = n 1+ n 2 ne dépend pas de z x p n 2 Flux des 2 o Flux des 1 n 1 z

Flux 1 Flux 2 (en général) n Pour conserver n : n D 12 = coefficient de diffusion = [L 2 T-1]

n Si 1 et 2 sont identiques : coefficient de diffusion simple. n On peut écrire :

Formule de Maxwell Chapman n m 1 et m 2 : masse des molécules

n Si m 2 >> m 1 (cas de particules dans un gaz)

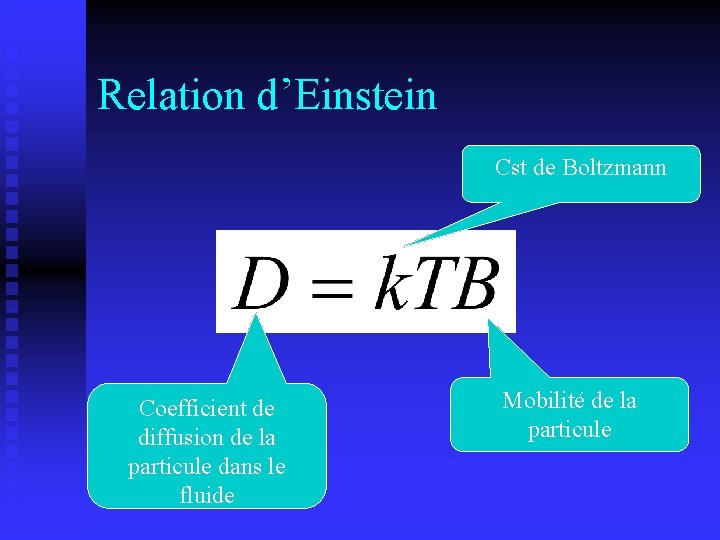
Relation d’Einstein Cst de Boltzmann Coefficient de diffusion de la particule dans le fluide Mobilité de la particule

Libre parcours moyen apparent d’un aérosol n Distance parcourue par la particule avant que sa direction change de /2. Vm= vitesse thermique moyenne de la particule

Temps de relaxation n Les particules sont soumises en permanence à des chocs. V 0 = vitesse moyenne (dans la direction oz) des particules à l’instant t 0 = temps de relaxation de l’aérosol

Distance d’arrêt d’un aérosol de vitesse initiale V 0 : n n A l’instant t la molécule à parcouru : Distance parcourue par la particule avant que sa direction ne change de /2.

Distance d’arrêt d’une particule n Mercer (1973) : pour 1 < Rep 0< 400


Fuchs (1964) n Particules de masse volumique 1000 kg/m 3 dans de l’air à pression atmosphérique et à 20 °C.

Equations de la diffusion : lois de Fick n 1ère loi de Fick : n 2ème loi de Fick :
 Arosols
Arosols Des des des
Des des des Loi générale des gaz
Loi générale des gaz Compressibilité des gaz niveau 2
Compressibilité des gaz niveau 2 équation des gaz alvéolaires
équation des gaz alvéolaires R=8 314
R=8 314 Pv=nrt
Pv=nrt La constante des gaz parfait
La constante des gaz parfait Loi des gaz parfaits
Loi des gaz parfaits Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Affiche plan marshall
Affiche plan marshall Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs La diffusion des idées des lumières
La diffusion des idées des lumières Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Robin des bois des alpes
Robin des bois des alpes Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Volume correspondant à une division
Volume correspondant à une division Volume d'un corps
Volume d'un corps Double des and triple des
Double des and triple des Présent de narration
Présent de narration Cartographie des flux
Cartographie des flux Diagramme d'ostwald gaz naturel
Diagramme d'ostwald gaz naturel Gaz turbina qurilmalari
Gaz turbina qurilmalari Boyle mariotte kanunu
Boyle mariotte kanunu Gaz kromatografisi dedektörleri
Gaz kromatografisi dedektörleri Kuldiruvchi gaz formulasi
Kuldiruvchi gaz formulasi