29 Elektrick proud v elektrolytech Elektrolyt elektrolytick disociace











- Slides: 12

29. Elektrický proud v elektrolytech

Elektrolyt, elektrolytická disociace, elektrolýza Roztoky kyselin, zásad a solí, popř. jejich taveniny, které vedou elektrický proud, se nazývají elektrolyty n Elektrolytická disociace je děj, při kterém nastává rozpad látky na ionty způsobený rozpouštědlem; je to samovolný proces, který končí dosažením rovnovážného stavu, při němž jsou přítomny vždy dva druhy iontů – kationty a anionty n Příklady: KCl -> K+ + Cl- Ca. Cl 2 -> Ca 2+ + 2 Cln Aby vznikl elektrický proud, je nutné vytvořit v elektrolytu elektrické pole, proto do elektrolytu vkládáme dvě elektrody připojené ke zdroji stejnosměrného napětí n Kladné ionty (kationty) se vždy pohybují ke katodě (elektrodě připojené k záporné svorce zdroje) a záporné ionty (anionty) se pohybují k anodě (elektrodě připojené ke kladné svorce zdroje). n Elektroda spojená s kladnou svorkou je anoda, elektroda spojená se zápornou svorkou je katoda n S přenosem elektrického náboje nastává i přenos látky, děj se nazývá elektrolýza n

Faradayovy zákony pro elektrolýzu n n 1. Faradayův zákon: Hmotnost m vyloučené látky je přímo úměrná součinu stálého proudu I a doby t, po kterou proud elektrolytem procházel m = A. I. t 2. Faradayův zákon: Elektrochemický ekvivalent látky vypočteme, jestliže její molární hmotnost vydělíme Faradayovou konstantou a počtem elektronů potřebných k vyloučení jedné molekuly: [kde F je Faradayova konstanta F = 9, 6481× 104 C. mol− 1 a z je počet (mocenství) elektronů, které jsou potřeba při vyloučení jedné molekuly (např. pro Cu 2+ → Cu je z = 2, pro Ag+ → Ag je z = 1)] Látková množství různých látek vyloučených při elektrolýze týmž nábojem jsou chemicky ekvivalentní. (Mohou se navzájem nahradit v chemické sloučenině nebo se mohou bezezbytku sloučit. ) - Veličina F = NAe ≈ 9, 6485· 104 C·mol-1 je Faradayova konstanta Konstanta úměrnosti A, která je pro danou látku charakteristická, se nazývá elektrochemický ekvivalent látky; jednotkou je kg · C 1

Voltampérová charakteristika vodiče n n n Voltampérová charakteristika je grafické znázornění závislosti proudu na napětí Pokud je napětí příliš malé, vznikne v určitém obvodu s elektrolytem velmi malý proud, který za krátkou dobu opět zanikne v důsledku polarizace elektrod Při postupném zvyšování napětí se tento jev opakuje tak dlouho, dokud není překročeno tzv. rozkladné napětí Rozkladné napětí Ur elektrolytu je napětí, od kterého se proud s napětím v elektrolytu lineárně zvyšuje, tedy platí vztah: R je odpor elektrolytu Graficky se tato závislost nazývá voltampérová charakteristika chemického zdroje a vypadá takto:

Alessandro Volta (1745 -1827) n n Celým jménem Alessandro Giuseppe Antonio Anastasio Volta Vynalezl elektrický článek, kondenzátor Pracoval jako profesor na univerzitě v Pávii Jeho příznivcem byl i Napoleon

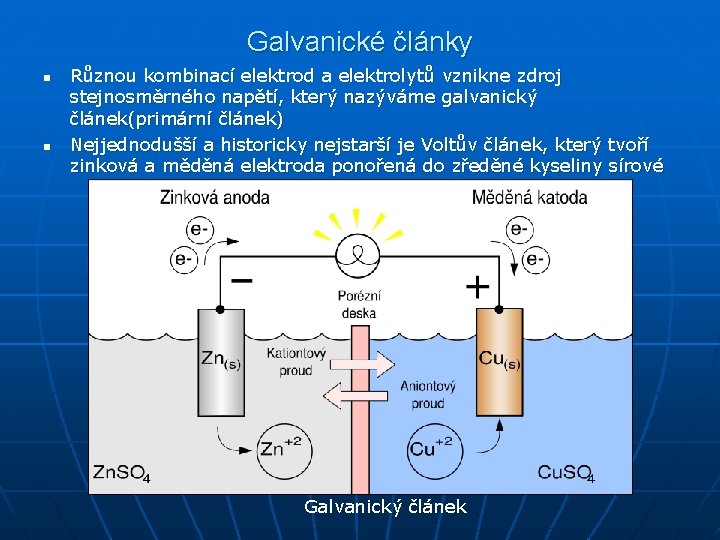
Galvanické články n n Různou kombinací elektrod a elektrolytů vznikne zdroj stejnosměrného napětí, který nazýváme galvanický článek(primární článek) Nejjednodušší a historicky nejstarší je Voltův článek, který tvoří zinková a měděná elektroda ponořená do zředěné kyseliny sírové Galvanický článek

Luigi Galvani (1737 -1798) n n n Celý život prožil v italské Boloni Studoval technologii, později medicínu Prováděl pokusy s živočišnou elektřinou

n n n Jestliže k tomuto článku připojíme spotřebič, obvodem prochází elektrický proud Napětí na svorkách zatíženého článku klesne na svorkové napětí Proud ve vnějším obvodu je tvořen elektrony, v elektrolytu ionty a na povrchu elektrod probíhá výměna nábojů Ze zinkové katody se odvádějí elektrody vnějším obvodem, rovnovážný stav mezi ní a elektrolytem se poruší V zapojeném Voltově článku se tedy z katody uvolňují do roztoku ionty Zn 2+ a vzniká síran zinečnatý, článek se postupně znehodnocuje Daniellův článek – se skládá ze zinkové elektrody ponořené do vodného roztoku Zn. SO 4 a měděné elektrody ponořené do vodného roztoku Cu. SO 4, oba elektrolyty jsou od sebe odděleny pórovitou stěnou, která zabraňuje smíchání, ale umožňuje přechod iontů; elektromotorické napětí tohoto článku je 1, 1 V

n n Suchý článek je druh galvanických článků, elektromotorické napětí je asi 1, 5 V, uvnitř probíhá elektrolýza, při ní se zinková elektroda rozpouští a na uhlíkové katodě se vylučuje vodík, který reaguje s burelem za vzniku vody, článek se postupně znehodnocuje Prototypem suchého článku byl Leclancheův článek [tvoří jej anoda z čistého uhlíku, katoda ze zinku a elektrolyt, kterým je směs burelu (Mn. O 2 a salmiaku (NH 4 Cl). Směs je ještě zahuštěná pilinami nebo pískem, odtud pochází označení „suchý článek“] n n Tři suché články za sebou tvoří plochou baterii s elektromotorickým napětím 4, 5 V Potřeba malých přenosných baterií s vyšším napětím si vynutila výrobu plošných článků, ve sdělovacích zařízeních se používají knoflíkové články

Elektrolytická polarizace n n n Elektrolytická polarizace je jev, kdy se za průchodu proudu mění v důsledku elektrolýzy povrchy elektrod, elektrody se pokrývají vyloučenými produkty, mění se kvalita a vznikají nové elektrické dvojvrstvy, elektrody se polarizují Elektromotorické napětí, které vznikne je tzv. polarizační napětí a má opačnou orientaci než napětí na původní dvojvrstvě Technickými úpravami se dá vliv polarizace omezit, elektrody se obalují látkou, která chemicky reaguje s produkty elektrolýzy, látka se nazývá depolarizátor

Akumulátor n n Akumulátor je tzv. sekundární zdroj stejnosměrného napětí, který je založen na vzniku elektrolytických potenciálů elektrod po proběhnutí vratných chemických dějů Můžeme jej nabíjet a vybíjet Skládá se z jednotlivých článků, které se spojují za sebou do akumulátorových baterií 6 V, 12 V nebo 24 V Schopnost akumulátoru akumulovat náboj vyjadřuje kapacita akumulátoru, udává se v ampérhodinách (A·h) Olověný akumulátor

Technické využití elektrolýzy n n n Vylučování kovů na katodě při elektrolýze se užívá v elektrometalurgii k získávání kovů z roztoků, v galvanostegii k pokovování, v galvanoplastice k vytváření odlitků, matric na výrobu gramofonových desek apod. Velké použití má elektrolytický kondenzátor, který tvoří dvě hliníkové nebo tantalové fólie, mezi nimiž je vrstva papíru napuštěná elektrolytem, na jedné fólii se elektrochemicky vytvoří tenká vrstva oxidu, která slouží jako dielektrikum, vzhledem k malé tloušťce dielektrika mají tyto kondenzátory poměrně velkou kapacitu – řádově 10 -6 F až 10 -2 F Zoxidovaná fólie elektrolytického kondenzátoru musí být zapojována do místa s vyšším potenciálem, jinak by se kondenzátor zničil (může dojít i k výbuchu, při němž se kondenzátor roztrhne)
 Elektrický proud v elektrolytech
Elektrický proud v elektrolytech Schématické značky vodič
Schématické značky vodič Střídavý proud prezentace
Střídavý proud prezentace Spirituální proud
Spirituální proud Language answer
Language answer Making proud choices
Making proud choices Example of paradox
Example of paradox Elektromagnetické jevy test
Elektromagnetické jevy test Imaginativní proud
Imaginativní proud Elektrický proud schématické značky
Elektrický proud schématické značky Honest open proud
Honest open proud Horský suťový proud
Horský suťový proud Which of the following is wrong about metaphysical poets
Which of the following is wrong about metaphysical poets























