2016 STTN STAV PRO KONTROLU LIV 5 3



























- Slides: 32

© 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 2 CERTIFIKACE KVALIFIKOVANOU OSOBOU A PROPOUŠTĚNÍ ŠARŽÍ - DOPLNĚK 16, VYR-32 Ing. František Chuchma, CSc. Seminář SÚKL 16. a 17. června 2016 Praha © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 3 Obsah Důvod změny Hlavní změny Závaznost Obecné zásady Postup certifikace Kontrola jakosti a certifikace šarže LP dovezeného ze třetí země Odpovědnosti kvalifikované osoby QP a posouzení SVP třetími stranami Řešení neočekávaných odchylek Propuštění šarže © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 4 Důvod změny Globalizace farmaceutických dodavatelských řetězců a nové strategie kontroly jakosti Zohlednění požadavků Směrnice 2011/62/EU (zabránění vstupu padělaných LP do legálního dodavatelského řetězce) Implementace ICH dokumentů Q 8, Q 9 a Q 10 Harmonizace výkladu některých bodů (např. odběr vzorků ve 3. zemích) © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 5 Hlavní změny Definuje odpovědnosti držitele rozhodnutí o registraci (MAH) x odpovědnosti kvalifikované osoby (QP) Odpovědnosti uvedené v kap. 1. 6 musí QP osobně splnit, odpovědnosti v kap. 1. 7 musí zajistit Mezi povinnostmi v kap. 1. 7 jsou např. zajištění dodavatelského řetězce, audity u dodavatelů, shoda výroby a kontroly jakosti s MA, validace procesů ve výrobě a KJ, hodnocení změn Úloha QP při řešení odchylek – implementace EMA Position Paper on QP Discretion Upřesnění požadavků na vzorkování dovážených LP Doplněk neuvádí všechny požadavky na dovoz – budou v připravovaném doplňku 21 © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 6 Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 Závaznost: Poskytuje pokyny k certifikaci kvalifikovanou osobou (QP) a k propouštění šarží léčivých přípravků pro humánní nebo veterinární použití Vztahuje se i na hodnocené LP pro humánní použití Ustanovení jsou uvedena v článku 51 Směrnice 2001/83/ES Nezabývá se „oficiálním propouštěním šarží kontrolním orgánem“ (OCABR) Základní podmínky propouštění šarží přípravku jsou stanoveny v rozhodnutí o registraci přípravku © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 7 Certifikace a propouštění QP – obecné zásady Konečnou odpovědnost za jakost, účinnost a bezpečnost LP nese držitel rozhodnutí o registraci (MAH) QP odpovídá za výrobu a KJ každé šarže v souladu s legislativou každého členského státu, s rozhodnutím o registraci a SVP. Proces propouštění šarží sestává z: • Kontroly výroby a zkoušení šarže • Certifikace konečného přípravku provedené QP • Přesunu k prodejným zásobám a/nebo vývozu šarže konečného přípravku (při rozdílných místech nutná písemná dohoda!). © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 8 Certifikace a propouštění QP – obecné zásady – pokračování Šarže byla vyrobena a zkontrolována v souladu s registrací Šarže byla vyrobena a zkontrolována v souladu se zásadami a pokyny SVP Byly zohledněny veškeré další relevantní právní požadavky Je zajištěna dohledatelnost záznamů při šetření závad v jakosti a stahování © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 9 Postup certifikace Každá šarže LP musí být certifikována QP v rámci EU před propuštěním k prodeji Certifikuje jen QP výrobce (dovozce), který je uveden v RD QP musí mít důkladné znalosti související s certifikací nebo konfirmací šarže. QP má dokládat vzdělávání pro danou oblast. QP provádějící certifikaci ručí za provedení nezbytných kroků v rámci farmaceutického systému jakosti bez ohledu na to, kolik míst se na výrobě a KJ zúčastní. U výrobních kroků v EU musí mít každé výrobní místo QP. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

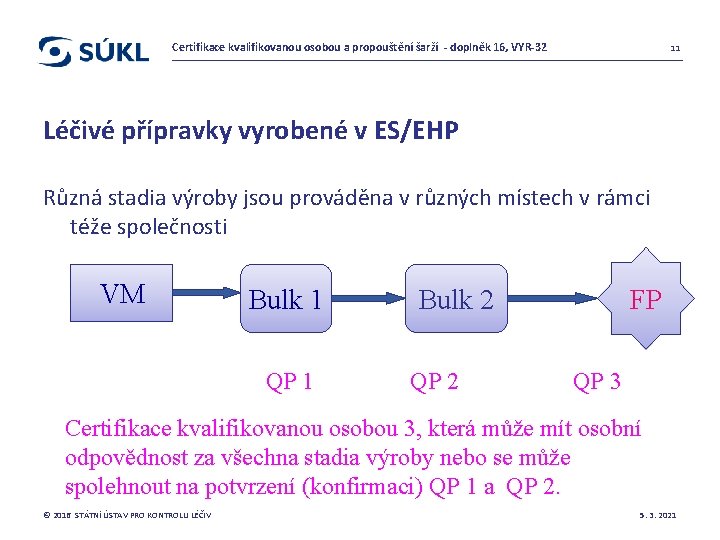
Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 10 Certifikace LP vyrobených v ES/EHP Výroba probíhá v jednom schváleném místě VM VM FP QP Osobní odpovědnost kvalifikované osoby je nastavena v rámci definovaného systému jakosti © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 11 Léčivé přípravky vyrobené v ES/EHP Různá stadia výroby jsou prováděna v různých místech v rámci téže společnosti VM Bulk 1 QP 1 FP Bulk 2 QP 3 Certifikace kvalifikovanou osobou 3, která může mít osobní odpovědnost za všechna stadia výroby nebo se může spolehnout na potvrzení (konfirmaci) QP 1 a QP 2. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

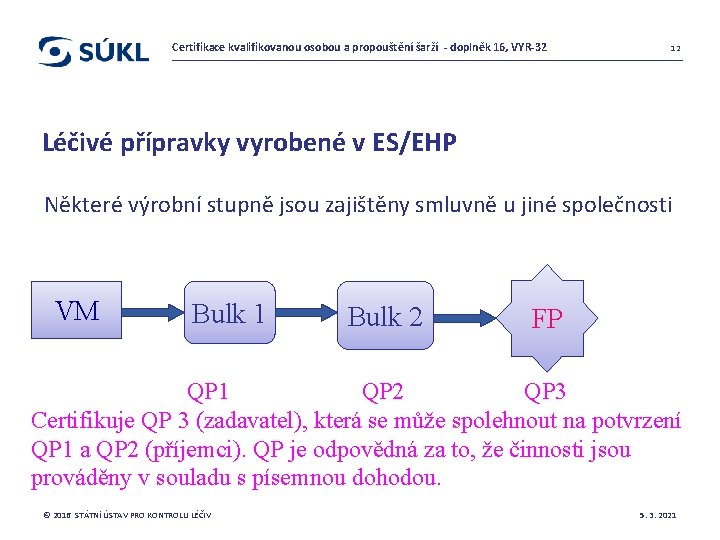
Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 12 Léčivé přípravky vyrobené v ES/EHP Některé výrobní stupně jsou zajištěny smluvně u jiné společnosti VM Bulk 1 Bulk 2 FP QP 1 QP 2 QP 3 Certifikuje QP 3 (zadavatel), která se může spolehnout na potvrzení QP 1 a QP 2 (příjemci). QP je odpovědná za to, že činnosti jsou prováděny v souladu s písemnou dohodou. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

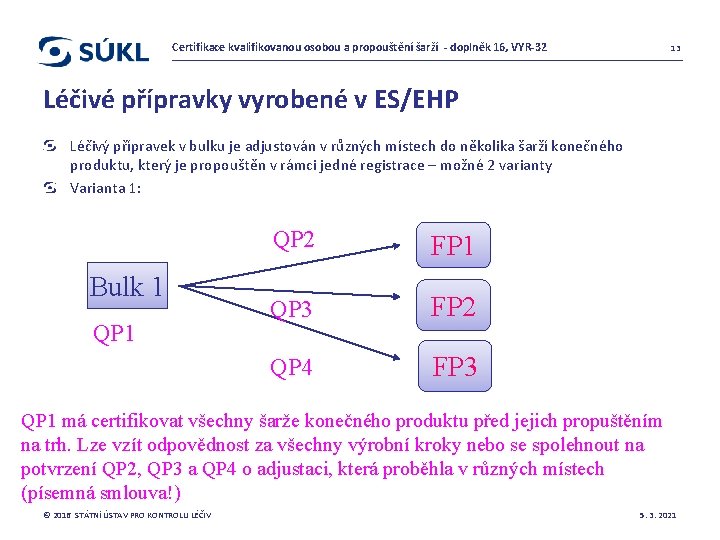
Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 13 Léčivé přípravky vyrobené v ES/EHP Léčivý přípravek v bulku je adjustován v různých místech do několika šarží konečného produktu, který je propouštěn v rámci jedné registrace – možné 2 varianty Varianta 1: Bulk 1 QP 2 FP 1 QP 3 FP 2 QP 4 FP 3 QP 1 má certifikovat všechny šarže konečného produktu před jejich propuštěním na trh. Lze vzít odpovědnost za všechny výrobní kroky nebo se spolehnout na potvrzení QP 2, QP 3 a QP 4 o adjustaci, která proběhla v různých místech (písemná smlouva!) © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 14 Léčivé přípravky vyrobené v ES/EHP Léčivý přípravek v bulku je adjustován v různých místech do několika šarží konečného produktu, který je propouštěn v rámci jedné registrace – možné 2 varianty Varianta 2: Bulk 1 QP 2 FP 1 QP 3 FP 2 QP 4 FP 3 QP 1 QP 2, QP 3 a QP 4 certifikují přípravek. Mohou na sebe vzít odpovědnost za všechny výrobní kroky nebo se spolehnou na potvrzení QP 1 za část výroby šarže v bulku. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 15 Léčivé přípravky vyrobené v ES/EHP Šarže bulku LP je adjustována v různých místech do několika šarží konečného přípravku, které jsou propuštěny v rámci různých registrací (např. generika) Bulk 1 QP 2 FP 1 QO 3 FP 2 QP 1 QP 4 FP 3 QP 2, QP 3 a QP 4 certifikují přípravek. Mohou na sebe vzít odpovědnost za všechny výrobní kroky nebo se spolehnout na potvrzení QP 1 za část výroby šarže v bulku (písemná smlouva). © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 16 Fyzický dovoz a certifikace šarže LP vyráběné mimo EU (1) Proces certifikace se vztahuje na LP určené pro trh EU nebo pro vývoz. QP certifikující šarži konečného LP může zohlednit konfirmace vystavené dalšími QP. Nutnost kontroly podmínek uchovávání a přepravy před certifikací. Odpovědnost certifikující QP za kontrolu výroby v souladu se SVP a registrací. Není-li platná MRA nebo obdobná dohoda – zajištění kvalitativní analýzy a kvantitativní analýzy v souladu s RD. Reprezentativnost odebraných vzorků (odběr po dodání do EU nebo v místě výroby ve 3. zemi). Písemná dohoda definuje odpovědnosti za odběr vzorků. Vzorky se mají přepravovat za podmínek jako daná šarže. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 17 Fyzický dovoz a certifikace šarže LP vyráběné mimo EU (2) Při odběru vzorků ve 3 Z uplatnit proces Analýzy rizik, který má zohlednit: • Audit výrobní činnosti zahrnující veškeré činnosti odběru vzorků – cílem je reprezentativnost vzorku pro dováženou šarži. • Komplexní vědeckou studii (popis procesu odběru, popis přepravních podmínek, srovnávací analýza vzorků, časový interval mezi odběrem vzorků a dovozem šarže). • Zajištění náhodné periodické analýzy vzorků po dovozu k podpoře spolehlivosti vzorkování. • Přezkum veškerých neočekávaných výsledků nebo potvrzených OOS. Nutno hlásit orgánu dozoru v místě certifikace v EU! © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

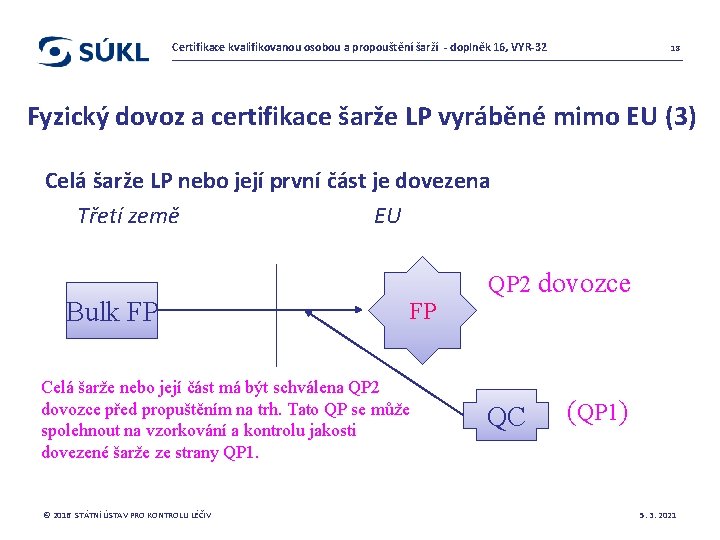
Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 18 Fyzický dovoz a certifikace šarže LP vyráběné mimo EU (3) Celá šarže LP nebo její první část je dovezena Třetí země EU Bulk FP QP 2 dovozce FP Celá šarže nebo její část má být schválena QP 2 dovozce před propuštěním na trh. Tato QP se může spolehnout na vzorkování a kontrolu jakosti dovezené šarže ze strany QP 1. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV QC (QP 1) 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 19 Fyzický dovoz a certifikace šarže LP vyráběné mimo EU (4) • • • Různé dovážené šarže pochází ze stejné šarže nerozplněného LP – QP může certifikovat na základě kontroly 1. dovezené šarže, nutná analýza rizik k zajištění spolehlivosti vzorků. Nutno ověřit hlavně: Splnění požadavků pro uchovávání nerozplněného LP. Šarže konečného LP je uchovávána a přepravována za stanovených podmínek. Zásilka nebyla porušena během uchovávání a přepravy. Byla stanovena správná identifikace přípravku. Testovaný vzorek je reprezentativní pro všechny šarže konečného LP. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

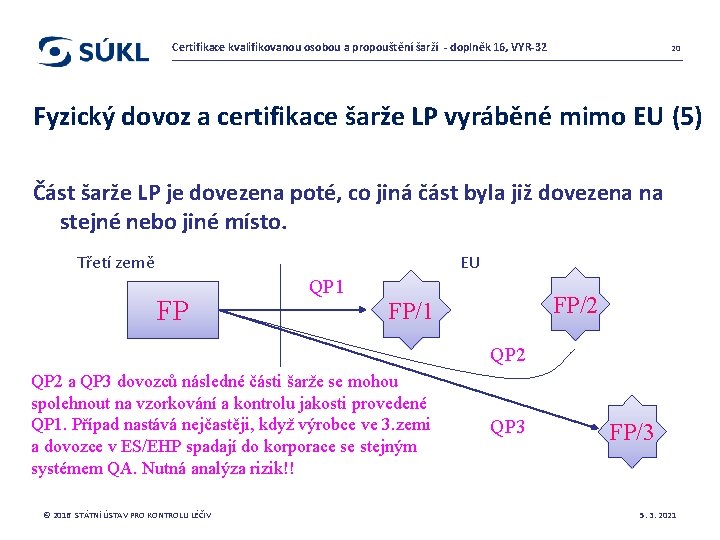
Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 20 Fyzický dovoz a certifikace šarže LP vyráběné mimo EU (5) Část šarže LP je dovezena poté, co jiná část byla již dovezena na stejné nebo jiné místo. Třetí země EU FP QP 1 FP/2 FP/1 QP 2 a QP 3 dovozců následné části šarže se mohou spolehnout na vzorkování a kontrolu jakosti provedené QP 1. Případ nastává nejčastěji, když výrobce ve 3. zemi a dovozce v ES/EHP spadají do korporace se stejným systémem QA. Nutná analýza rizik!! © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV QP 3 FP/3 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 21 Odpovědnosti QP (1) Před certifikací šarže propuštění musí QP zajistit alespoň následující požadavky: Certifikace je v souladu s povolením k výrobě a dovozu. Byly splněny další povinnosti a požadavky národní legislativy. Certifikace šarže LP je v registru LP nebo rovnocenném dokumentu. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 22 Odpovědnosti QP (2) QP je odpovědná za zajištění toho, že: Výroba a kontrola jakosti probíhala v souladu se SVP nebo v případě šarže dovážené ze třetí země v souladu se standardy SVP, Celý dodavatelský řetězec léčivé látky a léčivého přípravku až do fáze certifikace je doložen (je k dispozici QP), Dokument o dodavatelích zahrnuje místa výroby kritických materiálů (výchozí suroviny a obalové materiály, subdodavatelé kritických kroků), Šarže a její výroba vyhovují ustanovením registrační dokumentace Proběhly veškeré audity míst podílejících se na výrobě a zkoušení léčivých přípravků a LL © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 23 Odpovědnosti QP (3) Zdroj a specifikace výchozích materiálů odpovídají RD, dodavatelé mají zaveden systém řízení jakosti, Léčivé látky byly vyrobeny v souladu s SVP a distribuovány v souladu s SDP pro LL, Dovoz LL pro humánní použití má splňovat požadavky čl. 46(b) Směrnice 2001/83/ES U LP, které spadají do působnosti směrnice 2001/83/ES byly pomocné látky vyrobeny v souladu se SVP podle článku 46(f), Status TSE odpovídá podmínkám stanoveným v RD, Veškeré záznamy jsou kompletní a potvrzené včetně mezioperačních zkoušek © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 24 Odpovědnosti QP (4) Zásadní výrobní a zkušební postupy byly validovány; pracovníci mají potřebnou kvalifikaci a jsou proškoleni Výsledky zkoušení konečného LP odpovídají specifikaci nebo jsou v souladu s propouštěním v reálném čase (RTRT program), Jsou zohledněny registrační závazky pro uvedení LP na trh, průběžné údaje o stabilitě podporují certifikaci, Veškeré změny ve výrobě či kontrole jakosti byly dostatečně vyhodnoceny Byla dokončena šetření související s certifikovanou šarží (OOS, nevyhovující trendy), © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 25 Odpovědnosti QP (5) Řešené reklamace, stahování nejsou v rozporu s podmínkami certifikace, Byly uzavřeny související technické dohody, Program vnitřních inspekcí je aktivní a aktuální, Jsou zavedeny příslušné podmínky pro distribuci a přepravu, U LP pro humánní použití pro trh EU jsou na obale uvedeny ochranné prvky (podle čl. 54 (o) Směrnice 2001/83/ES) © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 26 Další požadavky (1) Další požadavky v Doplňku 2 „Výroba biologických LL a LP pro humánní použití“ a Doplněk 3 Výroba radiofarmak“ Souběžný dovoz a souběžná distribuce – operace přebalování dle schválení kompetentní autoritou pro zamýšlený trh: • QP potvrdí shodu s národními požadavky pro souběžný dovoz před certifikací šarže (nebo s pravidly EU pro souběžnou distribuci), • QP držitele MIA, který je stanoven jako odpovědný za certifikaci šarže pro přebalovaný přípravek potvrzuje soulad s příslušným povolením pro přebalení a SVP © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 27 Další požadavky (2) • • Záznam certifikace kvalifikovanou osobou: Záznam certifikace LP do registru nebo rovnocenného dokumentu Certifikovaná šarže splňuje ustanovení čl. 51 Směrnice 2001/83/ES Registr musí být pravidelně aktualizován a uchováván nejméně po dobu 5 let nebo delší dle požadavku příslušné autority Při přesunu šarže do jiného čl. státu musí být k dispozici protokol o kontrole podle čl. 51 Směrnice 2001/83/ES © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 28 QP a posouzení SVP třetími stranami Spoléhání se na posouzení třetími stranami, např. audity, by mělo probíhat v souladu s kapitolou 7 Pokynů k SVP Schválení zpráv z auditů: zohlednění obecných požadavků SVP, výroba a kontrola jakosti LP a LL v souladu s EU SVP nebo ekvivalentními požadavky u výroby ve třetích zemích, ověření shody s registrací u externě zadávaných činností, písemné závěrečné hodnocení a schválení zpráv z auditů třetí strany, přístup QP ke zprávám z auditů, uplatnění zásad řízení rizik pro jakost u externě zadávaných činností Opakování auditů dle zásad řízení rizik pro jakost © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 29 Řešení neočekávaných odchylek QP může uvažovat o potvrzení shody nebo certifikaci šarže, kde došlo k neočekávané odchylce výrobního procesu a/nebo metod analytických kontrol od údajů uvedených v rozhodnutí o registraci a/nebo SVP v případech, že byly splněny všechny zaregistrované specifikace. Dopad odchylky je nutno posoudit v souladu s procesem řízení rizik jakosti: • Vyhodnocení potencionálního dopadu odchylky na jakost, bezpečnost nebo účinnost. • Zahrnutí šarže do průběžného programu stability. • U biologických LP zvážit dopad odchylky na účinnost a bezpečnost. V případech, kdy se na konfirmaci a certifikaci podílí více QP zvážit dopad všech odchylek ve výrobě a kontrole jakosti. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 30 Propuštění šarže Šarže léčivých přípravků lze propustit k prodeji nebo dodávce na trh teprve po certifikaci kvalifikovanou osobou. Pokud není certifikována, lze ji přepravit v karanténě na místo schválené příslušnou autoritou. Bezpečnostní opatření, jimiž se zajistí, že necertifikované šarže nebudou přesunuty k prodejným zásobám (opatření fyzické nebo elektronické povahy). Kroky nezbytné pro oznámení certifikace kvalifikovanou osobou místu, kde má proběhnout přesun k prodejným zásobám, je třeba definovat v rámci technické dohody. © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Certifikace kvalifikovanou osobou a propouštění šarží - doplněk 16, VYR-32 31 Ostatní Rejstřík uvádí definici certifikace šarže konečného přípravku, definici konfirmace (podepsané prohlášení kvalifikované osoby), definici šarže konečného přípravku, definici dovozce a kvalifikované osoby. Dodatek I – Obsah konfirmace částečné výroby léčivého přípravku Dodatek II – Obsah certifikátu šarže léčivého přípravku Platnost od 15. dubna 2016 © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021

Děkujeme za pozornost STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 Praha 10 tel. : +420 272 185 111 fax: +420 271 732 377 e-mail: posta@sukl. cz © 2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 5. 3. 2021
 Sttn
Sttn Sttn
Sttn Lilie symbolika
Lilie symbolika Sttn
Sttn Sttn
Sttn Státní symboly čr
Státní symboly čr Eczanede stok kontrolü
Eczanede stok kontrolü Meme kanseri belirtileri
Meme kanseri belirtileri öfke kontrolü sunum ortaokul
öfke kontrolü sunum ortaokul Treyt kuramı
Treyt kuramı öfke kontrolü slayt rehberlik
öfke kontrolü slayt rehberlik Tedm
Tedm Cem yurtsev
Cem yurtsev Süreç kontrolü nedir
Süreç kontrolü nedir Evsel katı atık düzenli depolama tesisinde depolanabilir
Evsel katı atık düzenli depolama tesisinde depolanabilir Duygular nelerdir
Duygular nelerdir Aşağıdakilerden hangisi temel duygulardan biridir
Aşağıdakilerden hangisi temel duygulardan biridir Menstrüasyon evresi
Menstrüasyon evresi Poasie
Poasie Tkalcovský stav neolit
Tkalcovský stav neolit Stav sav
Stav sav Ssu stav
Ssu stav Spetni stav
Spetni stav Excitovaný stav fosforu
Excitovaný stav fosforu Stav sav
Stav sav Excitovaný stav příklady
Excitovaný stav příklady Rovnovážný stav soustavy
Rovnovážný stav soustavy Prilastek
Prilastek Excitovaný stav atomu
Excitovaný stav atomu Cosmology
Cosmology Testout server pro 2016
Testout server pro 2016 The macro pro pro maxcharltonmacrumors
The macro pro pro maxcharltonmacrumors Liv mjelde
Liv mjelde