2 o Principio della Termodinamica Equivalenza degli enunciati
















- Slides: 23

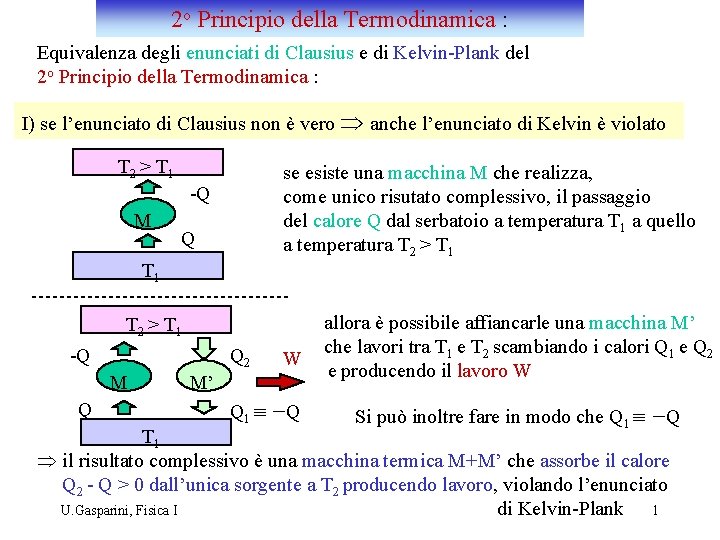
2 o Principio della Termodinamica : Equivalenza degli enunciati di Clausius e di Kelvin-Plank del 2 o Principio della Termodinamica : I) se l’enunciato di Clausius non è vero Þ anche l’enunciato di Kelvin è violato T 2 > T 1 se esiste una macchina M che realizza, come unico risutato complessivo, il passaggio del calore Q dal serbatoio a temperatura T 1 a quello a temperatura T 2 > T 1 -Q M Q T 1 T 2 > T 1 -Q Q 2 M Q W M’ Q 1 º - Q allora è possibile affiancarle una macchina M’ che lavori tra T 1 e T 2 scambiando i calori Q 1 e Q 2 e producendo il lavoro W Si può inoltre fare in modo che Q 1 º -Q T 1 Þ il risultato complessivo è una macchina termica M+M’ che assorbe il calore Q 2 - Q > 0 dall’unica sorgente a T 2 producendo lavoro, violando l’enunciato di Kelvin-Plank 1 U. Gasparini, Fisica I

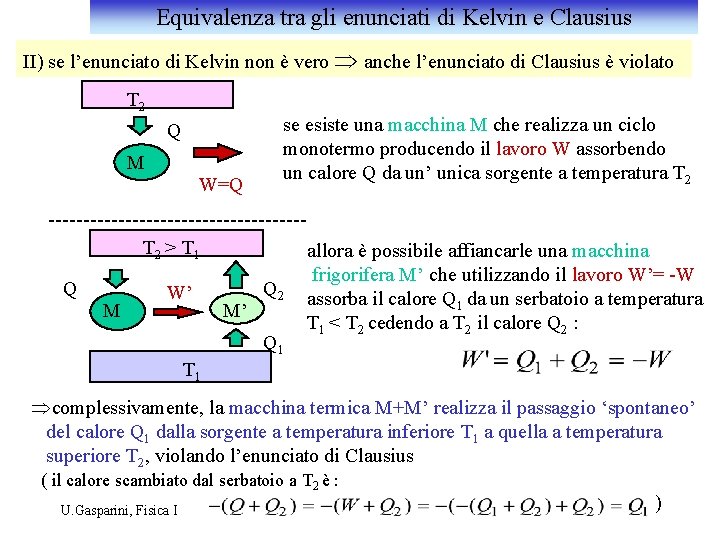
Equivalenza tra gli enunciati di Kelvin e Clausius II) se l’enunciato di Kelvin non è vero Þ anche l’enunciato di Clausius è violato T 2 Q M W=Q se esiste una macchina M che realizza un ciclo monotermo producendo il lavoro W assorbendo un calore Q da un’ unica sorgente a temperatura T 2 > T 1 Q M W’ M’ Q 2 Q 1 allora è possibile affiancarle una macchina frigorifera M’ che utilizzando il lavoro W’= -W assorba il calore Q 1 da un serbatoio a temperatura T 1 < T 2 cedendo a T 2 il calore Q 2 : T 1 Þcomplessivamente, la macchina termica M+M’ realizza il passaggio ‘spontaneo’ del calore Q 1 dalla sorgente a temperatura inferiore T 1 a quella a temperatura superiore T 2, violando l’enunciato di Clausius ( il calore scambiato dal serbatoio a T 2 è : U. Gasparini, Fisica I )

Teorema di Carnot Conseguenza del 2 o Principio della Termodinamica è il teorema di Carnot : “ Tutte le macchine termiche reversibili che operino fra due stesse sorgenti a temperature T 1 e T 2 hanno lo stesso rendimento h R ; ogni altra macchina irreversibile termica che lavori tra le due stesse sorgenti ha un rendimento h inferiore. ” La macchina termica di Carnot è una macchina reversibile che opera tra le sorgenti a temperature T 1 e T 2 ed ha rendimento : In generale quindi: Il rendimento della macchina di Carnot costituisce un limite superiore al rendimento di qualsiasi macchina che lavori tra le due temperature considerate; ciò è vero anche per macchine che lavorino scambiando calore con più di due sorgenti (a temperature intermedie tra T 1 e T 2 ; es. Macchina di Stirling). U. Gasparini, Fisica I 3

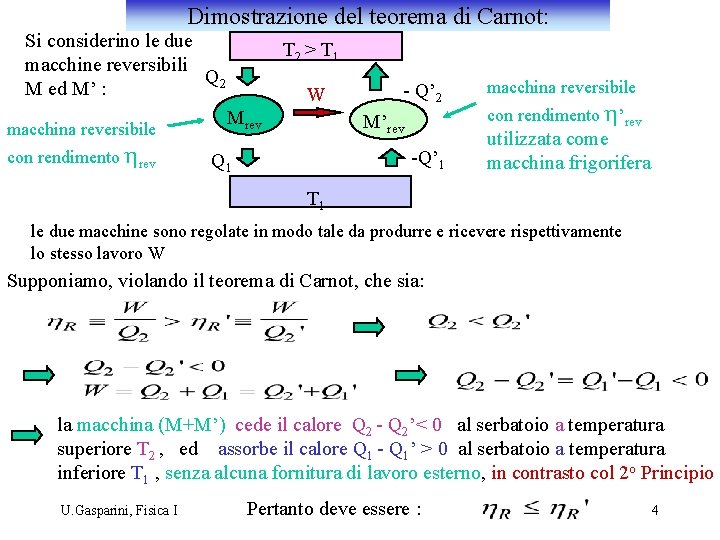
Dimostrazione del teorema di Carnot: Si considerino le due macchine reversibili Q 2 M ed M’ : macchina reversibile con rendimento hrev T 2 > T 1 W Mrev - Q’ 2 M’rev -Q’ 1 Q 1 macchina reversibile con rendimento h’rev utilizzata come macchina frigorifera T 1 le due macchine sono regolate in modo tale da produrre e ricevere rispettivamente lo stesso lavoro W Supponiamo, violando il teorema di Carnot, che sia: la macchina (M+M’) cede il calore Q 2 - Q 2’< 0 al serbatoio a temperatura superiore T 2 , ed assorbe il calore Q 1 - Q 1’ > 0 al serbatoio a temperatura inferiore T 1 , senza alcuna fornitura di lavoro esterno, in contrasto col 2 o Principio U. Gasparini, Fisica I Pertanto deve essere : 4

Dimostrazione del teorema di Carnot (II) Essendo M ed M’ macchine reversibili, il loro funzionamento può essere invertito, utilizzando M come macchina frigorifera ed M ’ come macchina termica: T 2 > T 1 Ripetendo il ragionamento, si ricava che per non violare il 2 o Principio, deve essere: -Q 2 W Mrev Q’ 2 M’rev -Q 1 Q’ 1 T 1 Confrontando le due diseguaglianze, si deduce: indipendentemente dal sistema termodinamico che compie il ciclo nella macchina M e M’. Se la macchina M è irreversibile con rendimento hirr , resta dimostrato , dalla prima parte del ragionamento, che: mentre non è possibile invertire il funzionamento di M. Pertanto: U. Gasparini, Fisica I 5

Temperatura termodinamica assoluta Il teorema di Carnot permette di definire una scala assoluta delle temperature, detta “temperatura termodinamica assoluta” che è indipendente dalle caratteristiche di un particolare sistema termodinamico (termometro) : si assume come “caratteristica termometrica” il calore scambiato da una macchina reversibile tra la sorgente la cui temperatura si vuole definire ed una sorgente di temperatura convenzionalmente prefissata (ad es. , alla temperatura del punto triplo dell’acqua, fissata per convenzione uguale a 273, 16 K). Detta q una generica “temperatura empirica” (ad es. quella misurata da un termometro a gas ideale) , si definisce la temperatura termodinamica assoluta : calore scambiato da una qualsiasi macchina reversibile col serbatoio alla temperatura q calore scambiato dalla macchina reversibile col serbatoio alla “temp. di riferimento” del punto triplo dell’acqua : gtr º g(q tr ) = 273, 16 K Il teorema di Carnot assicura che g è unicamente funzione di q. U. Gasparini, Fisica I 6

Temperatura assoluta e temperatura del termometro a gas ideale In particolare, date due sorgenti alle temperature empiriche q 1 e temperature termodinamiche assolute sono: q 2 , le loro e ossia: Se si considera la temperatura empirica q=T del termometro a gas ideale, sappiamo che: Pertanto: le scale della temp. termodinamica assoluta e del termometro a gas ideale sono proporzionali: Poichè inoltre al punto triplo dell’acqua esse coincidono: ossia: la scala della temperatura termodinamica assoluta e della temperatura del termometro a gas ideale coincidono U. Gasparini, Fisica I 7

Teorema di Clausius Conseguenza del 2 o Principio della Termodinamica è il “Teorema di Clausius” : per una qualsiasi macchina termica che compie una trasformazione ciclica, la somma dei calori Q i scambiati divisi per le temperature Ti dei serbatoi con i quali avvengono gli scambi di calore è minore o uguale a zero, dove il segno di uguaglianza vale per le macchine reversibili: calore scambiato col serbatoio i-esimo temperatura assoluta del serbatoio i-esimo Esso generalizza del teorema di Carnot a cicli termodinamici con scambi di calore con un numero arbitrario di serbatoi. Per un ciclo che scambi calore con soli 2 serbatoi, infatti: teorema di Carnot: U. Gasparini, Fisica I 8

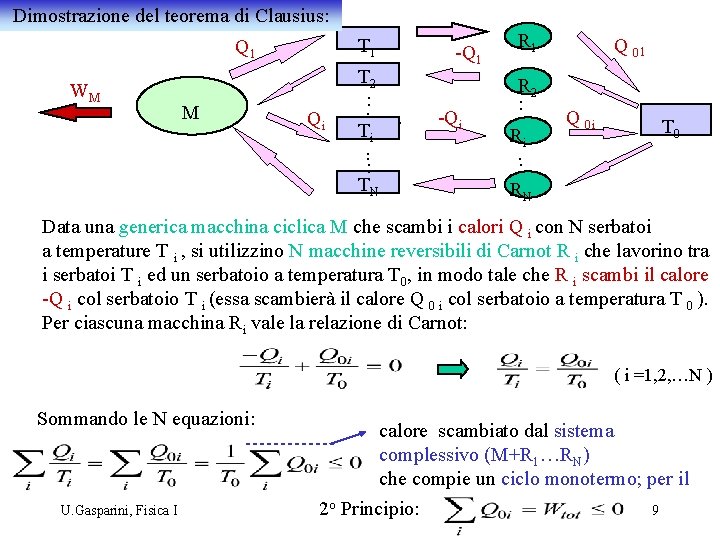
Dimostrazione del teorema di Clausius: T 1 Q 1 WM M Qi T 2 : . Ti. . : TN -Q 1. -Qi R 1 R 2 : . Ri. : RN Q 01 Q 0 i T 0 Data una generica macchina ciclica M che scambi i calori Q i con N serbatoi a temperature T i , si utilizzino N macchine reversibili di Carnot R i che lavorino tra i serbatoi T i ed un serbatoio a temperatura T 0, in modo tale che R i scambi il calore -Q i col serbatoio T i (essa scambierà il calore Q 0 i col serbatoio a temperatura T 0 ). Per ciascuna macchina Ri vale la relazione di Carnot: ( i =1, 2, …N ) Sommando le N equazioni: U. Gasparini, Fisica I calore scambiato dal sistema complessivo (M+R 1…RN) che compie un ciclo monotermo; per il 2 o Principio: 9

Disuguaglianza di Clausius Se la macchina M scambia calore con infiniti serbatoi a temperatura T (ossia T è una variabile continua), la relazione di Clausius si generalizza : quantità infinitesima di calore scambiata col serbatoio a temperatura T temperatura del serbatoio col quale avviene lo scambio di calore d. Q Se la macchina M è reversibile, deve valere la relazione di uguaglianza, altrimenti invertendo il modo di lavorare di M e di tutte le macchine R i , sarebbe possibile ottenere un ciclo monotermo che produce lavoro, violando il 2 o Principio : U. Gasparini, Fisica I 10

Entropia Il teorema di Clausius permette di introdurre una nuova funzione dello stato termodinamico del sistema, l’ “entropia” S, tale che la sua variazione tra uno stato iniziale 1 e uno stato finale 2 sia : dove l’integrale è calcolato lungo una qualsiasi trasformazione reversibile che porti il sistema dallo stato 1 allo stato 2. In virtù del teorema di Clausius tale integrale non dipende dalla trasformazione reversibile scelta, e pertanto definisce una funzione unicamente dei parametri termodinamici del sistema nei due stati finale e iniziale : (I) 1 2 (II) U. Gasparini, Fisica I 11

Principio dell’aumento dell’entropia per un sistema isolato Considerando un ciclo irreversibile, costituito da una trasformazione (1) irreversibile e da una trasformazione (II) reversibile, dalla disuguaglianza di Clausius: (I) DS 21º S(1)-S(2) 1 2 (II) Þ In particolare, per un sistema isolato che compia una trasformazione irreversibile da uno stato 1 a uno stato 2, essendo d. Q º 0 : “principio dell’aumento dell’entropia” per un sistema isolato ( N. B: un sistema non isolato che compia una trasformazione irreversibile può ovviamente diminuire la propria entropia) U. Gasparini, Fisica I 12

“Energia inutilizzabile”: energia che in un processo irreversibile viene “sprecata”, ossia non viene utilmente trasformata in lavoro a causa della irreversibilità del processo: è la differenza tra il lavoro W ottenuto nel processo considerato ed il lavoro WR che si sarebbe ottenuto da un processo reversibile che realizzasse gli stessi scambi di calore: La variazione di entropia dell’ ”Universo” ( sistema che compie la trasformazione + ambiente che scambia calore col sistema) , moltiplicata per la temperatura inferiore tra quelle in gioco negli scambi di calore, è una misura di tale energia “inutilizzata”. Esempi: i) macchina che produce il lavoro W lavorando tra due serbatoi: T 2 > T 1 Q 2 M Q 1 W=Q 1+ Q 2 U. Gasparini, Fisica I T 1 13

“Energia inutilizzabile” (II) ii) per un passaggio “spontaneo” di calore tra due sorgenti senza alcuna produzione di lavoro ( W=0 ) : T 2 > T 1 Q T 1 iii) espansione “libera” di Joule di un gas ideale: W=0 U. Gasparini, Fisica I 14

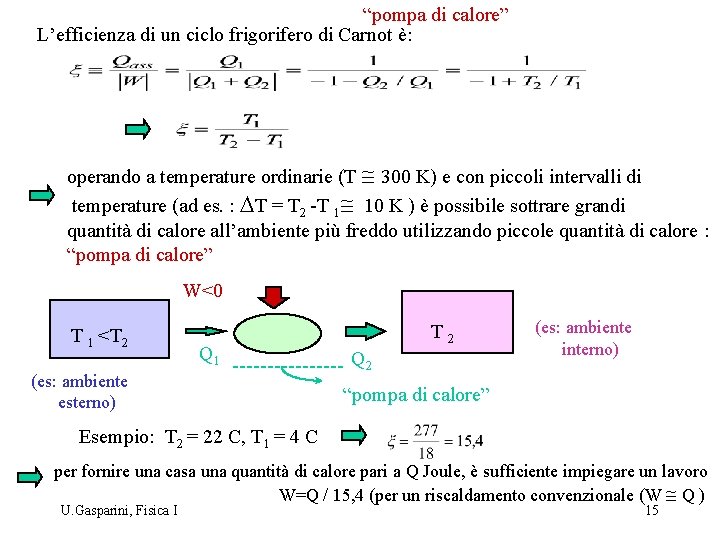
“pompa di calore” L’efficienza di un ciclo frigorifero di Carnot è: operando a temperature ordinarie (T @ 300 K) e con piccoli intervalli di temperature (ad es. : DT = T 2 -T 1@ 10 K ) è possibile sottrare grandi quantità di calore all’ambiente più freddo utilizzando piccole quantità di calore : “pompa di calore” W<0 T 1 <T 2 Q 1 (es: ambiente esterno) T 2 Q 2 (es: ambiente interno) “pompa di calore” Esempio: T 2 = 22 C, T 1 = 4 C per fornire una casa una quantità di calore pari a Q Joule, è sufficiente impiegare un lavoro W=Q / 15, 4 (per un riscaldamento convenzionale (W @ Q ) U. Gasparini, Fisica I 15

Diagramma T-S : Gli stati termodinamici e le trasformazioni termodinamiche possono essere rappresentati in un “diagramma T-S” : T f Tf T(S) Ti i Si Sf S In un diagramma T-S, l’area sottesa dalla curva rappresentativa di una trasformazione reversibile è uguale al calore scambiato dal sistema nella trasformazione: Per una trasformazione ciclica reversibile, le aree incluse nelle curve chiuse rappresentative del ciclo nei diagrammi p-V e T-S sono uguali, essendo, per il 1 o Principio: W=Q Wciclo Qciclo B p T B A A U. Gasparini, Fisica I S V 16

Diagramma T-S per il ciclo di Carnot: p A B D trasf. isoterma T T 2 C T 1 V T 2 A B T 1 D C SA=SD trasf. isoentropica SC=SB S Utilizzando il diagramma T-S, il calcolo del rendimento del ciclo è immediato: ed essendo: U. Gasparini, Fisica I 17

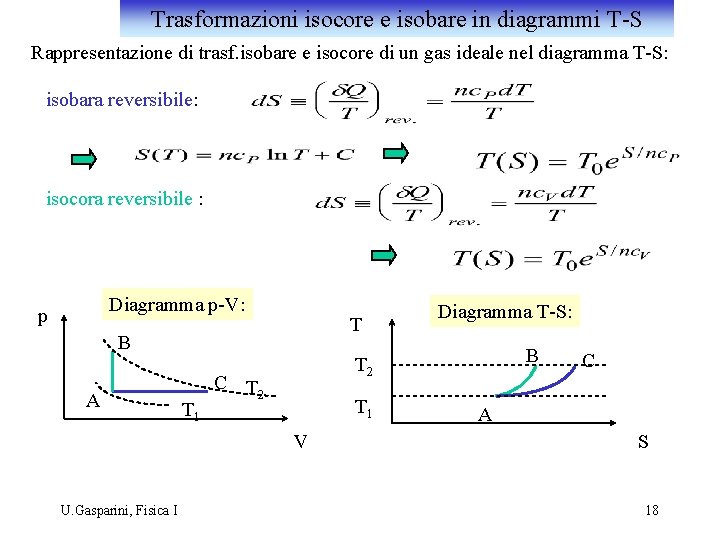
Trasformazioni isocore e isobare in diagrammi T-S Rappresentazione di trasf. isobare e isocore di un gas ideale nel diagramma T-S: isobara reversibile: isocora reversibile : Diagramma p-V: p T B A T 1 B T 2 C T 2 T 1 V U. Gasparini, Fisica I Diagramma T-S: C A S 18

Potenziali termodinamici E’ possibile definire funzioni di stato, genericamente chiamati “potenziali termodinamici”, che in virtù dei Principi della Termodinamica, ossia : 1 o Principio Þ 2 o Principio Þ hanno la caratteristica di assumere il valore minimo, in determinati tipi di trasformazione, quando il sistema raggiunge l’equilibrio termodinamico ( in analogia con i sistemi meccanici, che sono in una posizione di equilibrio stabile quando è minima l’energia potenziale del sistema) Per qualsiasi trasformazione: ( 1 o Principio ) U. Gasparini, Fisica I ( 2 o Principio: disuguaglianza di Clausius ) 19

“Entalpia” : ( Þ in un gas ideale: Þ l’entalpia è, come l’energia interna, funzione della sola temperatura ) In un processo isobaro: la variazione di entalpia è uguale al calore scambiato: nelle reazioni chimiche (processi isobarici): trasf. esotermiche (producono calore): trasf. endotermiche (assorbono calore): Nei processi isobari ed isoentropici (dp = 0, d. S=0): dp=0 =0 l’entalpia assume il valore minimo nelle trasformazioni isobare e isoentropiche U. Gasparini, Fisica I 20

Potenziali termodinamici “Energia libera “(o “potenziale di Helmotz”): Nelle trasf. isocore e isoterme, dalla disuguaglianza: d. V=0 d. T=0 l’energia libera assume il valore minimo nelle trasformazioni isocore e isoterme “Entalpia libera” (o “potenziale di Gibbs”) : Nelle trasf. isobare e isoterme, dalla disuguaglianza: dp=0, d. T=0 Þ U. Gasparini, Fisica I l’entalpia libera assume il valore minimo nelle trasformazioni isobare e isoterme 21

Esempio di trasformazione isoentalpica: espansione adiabatica di Joule-Thomson di un gas attraverso un setto poroso (1853) : gas setto poroso p. A p. B< p. A VA, TA VB, TB Il gas passa da una parte all’altra del setto, per effetto dell’azione dei due pistoni; nella trasformazione: (processo adiabatico) 1 o Principio: Þ Þ la trasformazione è isoentalpica U. Gasparini, Fisica I 22

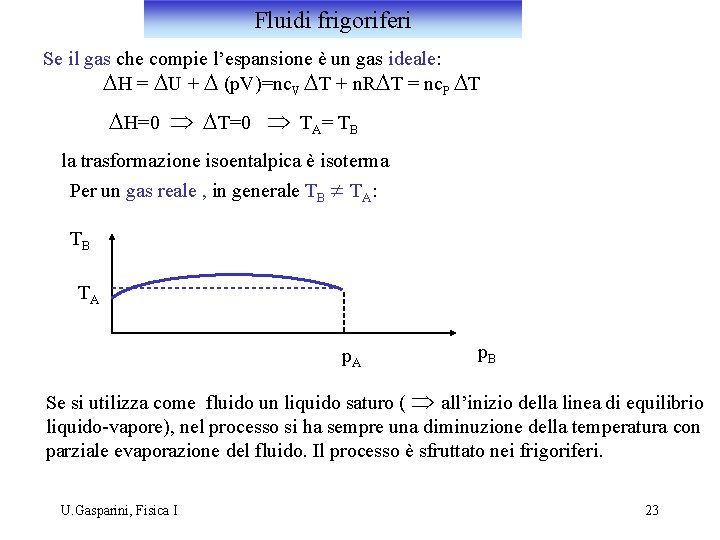
Fluidi frigoriferi Se il gas che compie l’espansione è un gas ideale: DH = DU + D (p. V)=nc. V DT + n. RDT = nc. P DT DH=0 Þ DT=0 Þ TA= TB la trasformazione isoentalpica è isoterma Per un gas reale , in generale TB ¹ TA: TB TA p. B Se si utilizza come fluido un liquido saturo ( Þ all’inizio della linea di equilibrio liquido-vapore), nel processo si ha sempre una diminuzione della temperatura con parziale evaporazione del fluido. Il processo è sfruttato nei frigoriferi. U. Gasparini, Fisica I 23
 Equivalenza kelvin clausius
Equivalenza kelvin clausius Primo principio della termodinamica enunciato
Primo principio della termodinamica enunciato Primo principio della termodinamica
Primo principio della termodinamica 2 principio della termodinamica formula
2 principio della termodinamica formula Principio 0 della termodinamica
Principio 0 della termodinamica Coefficiente di joule thomson
Coefficiente di joule thomson Formule inverse rendimento carnot
Formule inverse rendimento carnot 1 principio della termodinamica
1 principio della termodinamica Arqumedes
Arqumedes Terzo principio della termodinamica
Terzo principio della termodinamica 2 principio della termodinamica formula
2 principio della termodinamica formula Termodinmica
Termodinmica Primo principio termodinamica
Primo principio termodinamica Legge fondamentale della termologia formule inverse
Legge fondamentale della termologia formule inverse Objetivos de la termodinamica
Objetivos de la termodinamica Trasformazioni termodinamiche zanichelli
Trasformazioni termodinamiche zanichelli Due equazioni sono equivalenti quando
Due equazioni sono equivalenti quando Conseguenze secondo principio di equivalenza
Conseguenze secondo principio di equivalenza Quando due equazioni sono equivalenti
Quando due equazioni sono equivalenti Primo principio disequazioni
Primo principio disequazioni Enunciati composti
Enunciati composti Termodinamica degli stati
Termodinamica degli stati Principios de la termodinamica
Principios de la termodinamica Tercer principio de la termodinamica
Tercer principio de la termodinamica