2 maruza Kimyoviy reaksiyalarning tezligi 2 NOgO 2g

















![[A], [B], [C], [D] – muvozanat konsentratsiyalari; a, b, c, d- reaksiya tenglamasining [A], [B], [C], [D] – muvozanat konsentratsiyalari; a, b, c, d- reaksiya tenglamasining](https://slidetodoc.com/presentation_image_h/1f63266b8aade999009834cc8f0add64/image-20.jpg)


- Slides: 22

2 -ma’ruza: Kimyoviy reaksiyalarning tezligi 2 NO(g)+O 2(g)= 2 NO 2(g) (1) G=-150 k. J/mol 2 H 2+O 2=2 H 2 O (2) G=-456, 5 k. J/mol (2) 1000 o. S da ( G=-495, 3 k. J/mol) bir lahzada. Reaksiyalarning borish mexanizmi va tezligi kimyoviy kinetikada o’rganiladi. geterogen va gomogen. Reaksiyalar tezligi Tezlikini tekshirishda sistemaning biror-bir xossasi o’zgarishi (elektr o’tkazuvchanligi, rangi, bosimi, spektri, kons. ) olinadi: C 2 - C 1 C V = ------- = ---- t 2 - t 1 t C 2 va C 1 reaksiayaga kirishuvchi moddalar kons. (mol/l); t 2 va t 1 - vaqt (sek. ); - o’zgarish belgisi;

Tezlik birligi: mol/l*sek. Haqiqiy tezlik: d. S V = --- dt Kons. o’zgarishi(d. S) bilan vaqt o’zgarishi esa(dt); Gomogen reaksiyalar: C 1 -C 2 n 1 -n 2 V= -------; V=-------. ( t 2 -t 1)*V (t 2 -t 1)*V C 2 va C 1 moddalarning konsentrasiyasi; V- sistema hajmi; n 1 va n 2 moddalar miqdori; Geterogen reaksiyalarda tezlik modda miqdorining yuza birligida o’zgarashi orqali hisobga olinadi.

Reaksiya tezligiga ta’sir etuvchi omillar Reaksiyaning tezligi moddalarning tabiatiga, kons. , haroratga, katalizatorga bog’liq. Massalar ta’siri qonuni. 1867 y. norvegiyalik olimlar Guldberg va Vaagelar ta’riflangan: Kimyoviy reaksiya tezligi reaksiyaga kirishuvchi moddalar konsentratsiyalari ko’paytmasiga to’g’ri proporsional. a. A + b. B = c. C + d. D V = k [A]a [B]b V -reaksiya tezligi; [A] va [B] - moddalar kons. ; a va b stexeometrik koeffisientlar; k- proporsionallik koeffitsienti, tezlik konstantasi; K- reaksiyaga kirishuvchi moddalar tabiatiga, haroratga va katalizatorga bog’liq.

Tezlik konstantasi reaksiyaga kirishuvchi moddalar konsenratsiyalari 1 mol/l ga teng bo’lgan paytdagi reaksiyaning tezligini ko’rsatadi. H 2+I 2=2 HI; V=k[H 2]*[I 2] NH 4 Cl+H 2 O=NH 4 OH+HCl; V=k[NH 4 Cl]*[H 2 O] Agar kimyoviy jarayon gazlardan bo’lsa tezli: : N 2+3 H 2=2 NH 3; V=k[P N 2]1*PH 2]3 Qattiq moddalar uchun: CO 2(g)+C(q)=2 CO(g); V=k[PCO 2] 2 P+5 Cl 2=2 PCl 5; V=k[PCl 2]5 Reaksiya tezligiga haroratning ta’siri Vant-Goff qoidasi bilan ifodalanadi: Harorat har 10 o. С ga oshirilganda reaksiya tezligi 2 -4 marta tezlashadi.

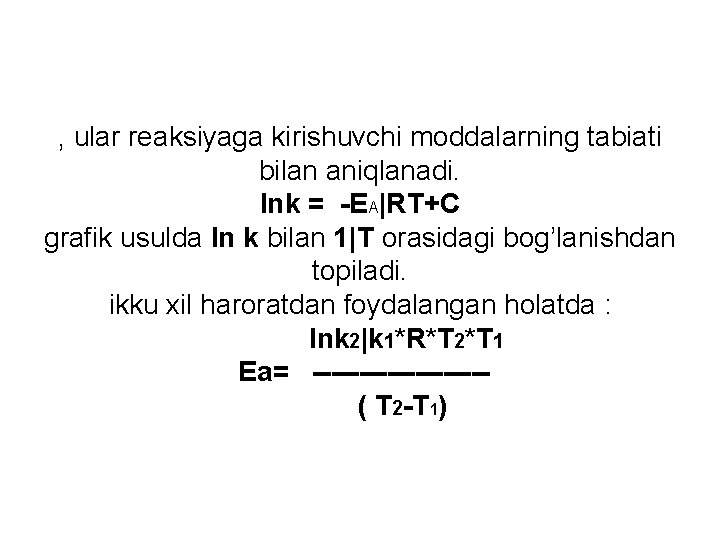
Reaksiya tezligiga temperatura ta’sirini (Vant-Goff) Vt 2 ( t 2 - t 1)/10 ---- = Vt 1 - harorat koeffitsientil, u harorat 10 o. S ga ortganda reaksiya tezligi necha marta ortishini ko’rsatadi. -E a|RT Arrenius tenglamasi: K = Ae Ea - faollanish energiyasi; A - vaqt birligi ichida reaksiyada qatnashuvchi zarrachalar orasidagi to’qnashuvlarning umumiy soni; R - universal gaz doimiysi (8, 31 J/mol*K); T - mutloq harorat, K. Echimi: lnk = -B|T +C B va C - haroratga bog’liq bo’lmagan doimiy sonlar

, ular reaksiyaga kirishuvchi moddalarning tabiati bilan aniqlanadi. lnk = -EA|RT+C grafik usulda ln k bilan 1|T orasidagi bog’lanishdan topiladi. ikku xil haroratdan foydalangan holatda : lnk 2|k 1*R*T 2*T 1 Ea= --------- ( T 2 -T 1)

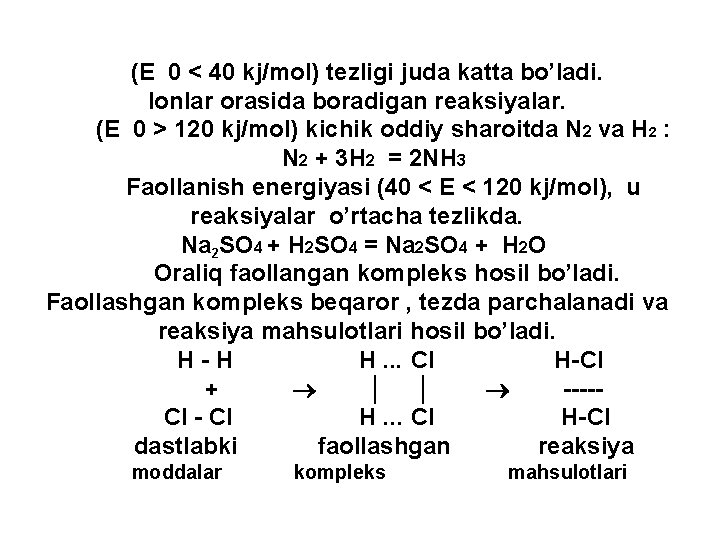
(E 0 < 40 kj/mol) tezligi juda katta bo’ladi. Ionlar orasida boradigan reaksiyalar. (E 0 > 120 kj/mol) kichik oddiy sharoitda N 2 va H 2 : N 2 + 3 H 2 = 2 NH 3 Faollanish energiyasi (40 < E < 120 kj/mol), u reaksiyalar o’rtacha tezlikda. Na 2 SO 4 + H 2 SO 4 = Na 2 SO 4 + H 2 O Oraliq faollangan kompleks hosil bo’ladi. Faollashgan kompleks beqaror , tezda parchalanadi va reaksiya mahsulotlari hosil bo’ladi. H - H H. . . Cl H-Cl + │ │ ---- Cl - Cl H. . . Cl H-Cl dastlabki faollashgan reaksiya moddalar kompleks mahsulotlari

Reaksiyalarning molekulyarligi va tartibi Konsentratsiyaning nechanchi darajasiga bog’liqligini ko’rsatuvchi son reaksiyaning tartibi. Reaksiyalar birinchi tartibli(V=k. C); 2 ikkinchi tartibli(V=KC); 3 uchinchi tartibli (V=k. C); nolinchi va kasr tartibli bo’ladi. Nolinchi tartibli reaksiyalar geterogen jarayonlarda, reaksiyalarda moddaning reaksion muhitga kiritilishi uning sarflanishidan yuqori. O tartibli reaksiyalar (V=k) reaksiya tezligi konsentratsiyaga bog’liq emas.

Monomolekulyarli reaksiyalar, odatda birinchi tartiblidir: A B ; A B+C; J 2 = J + J V = k [J 2] Parchalanish, radioaktiv emirilish, izomerlanish reaksiyalari monomolekulyar reaksiyalar qatoriga kiradi. Bi yoki di (ikki) molekulyar reaksiyalar ko’p uchraydi va ular ikkinchi tartibli hisoblanadi: A+B C ; 2 A B; H 2 + J 2 = 2 HJ; V = k[H 2][J 2] Tri (uch) molekulyarli reaksiyalar kamdan-kam uchrab, ular uchinchi tartibli reaksiyalarga kiradi: A+B+C D; 2 A+B C+D; 3 A C; 2 NO + Cl 2 =2 NOCl; V = k [NO] 2[Cl 2]I Agar reaksiyaga kirishuvchi moddalardan biri juda ko’p miqdorda olinsa (saxarozaning gidrolizi) va faqat bir moddaning konsentrasiyasi o’zgarsa molekulyarlik va tartib mos kelmaydi. C 12 H 22 O 11+H 2 O=C 6 H 12 O 6 + C 6 H 12 O 6 Mexanizmiga ko’ra bu reaksiya bimolekulyar, lekin birinchi tartiblidir.

Reaksiyalarning tartibini aniqlash n Vant-Goff usulu: V=k. C lg. V = lgk+nlg. C; y = lg. V; A = lgk; B=n; x = lg. C; y =A+Bx

oddiy va murakkab. Agar reaksiya faqat bir bosqichda borsa, oddiy reaksiya. Parchalanish, izomerlanish, radoaktiv parchalanish. Oddiy reaksiyalarda reaksiya tenglamasi haqiqatda ketayotgan reaksiya jarayoniga mos keladi. Murakkab reaksiyalar : Parallel, ketma-ket, tutash, zanjir. Parallel reaksiyalar bir vaqtning o’zida bir necha yo’nalishda boradi. V 1 ┌─ 2 KCl + 3 O 2 6 KCl. O 3 V=V 1+V 2 V 2 └─ 3 KCl. O 4 + KCl Reaksiya tezligi alohida olingan reaksiyalarning tezliklarining yig’indisiga teng.

Ketma-ket reaksiyalar : H 3 PO 4 + Na. OH = Na. H 2 PO 4 + H 2 O V 1 Na. H 2 PO 4 + Na. OH = Na 2 HPO 4 + H 2 O V 2 Na 2 HPO 4 + Na. OH = Na 3 PO 4 + H 2 O V 3 Sekin boruvchi jarayon(V 3) bilan. Tutash reaksiyalarda ikki reaksiyadan biri ikkinchisining borishini ta’minlaydi: A+B=D; A+C=E B induktor ; C modda akseptor. Ikkala reaksiya uchun zarur A aktor. 6 Fe. O + 2 H 2 Cr. O 4 = 3 Fe 2 O 3 + Cr 2 O 3 + 2 H 2 O 6 HJ + 2 H 2 Cr. O 4 = 3 J 2 + Cr 2 O 3 + 5 H 2 O H 2 Cr. O 4 -aktor, Fe. O-induktor, HI akseptor hisoblanadi.

Qaytar reaksiyalar – qarama qarshi ikki yo’nalishda ketadigan reaksiyalardir. A B; VA=k 1 CA; VB=k 2 CB; V=VA-VB Reaksiyada A modda kons. kamayib B moddaning kons. ortib boradi. Kimyoviy muvozanat sodir bo’ladi. VA=VB

Zanjir reaksiyalar bir-biri bilan ulangan ketma-ket, parallel, tutash reaksiyalar hamda erkin radikallar ishtirokida boradi. Yonish, oksidlanish, radioaktiv yemirilish, polimerlanish, polikondensatsiya, fotokimyoviy. Uch bosqichda: 1) zanjirning hosil bo’lishi; 2) zanjirning rivojlanishi; 3) yoki o’sishi va zanjirning uzilishi; mexanizmi erkin radikallarning hosil bolishi va ularning aktivligi juda yuqoriligi bilan bog’langan. HCl : h Cl 2 2 Cl* H 2 + Cl* HCl + H* (zanjirning o’sishi) Cl 2 + H* HCl + Cl* H*+ Cl* HCl (zanjirning uzilishi) Cl*+ Cl* Cl 2 H*+ H* H 2

Kataliz. Katalitik reaksiyalar. Kimyoviy reaksiyaning tezligini oshirib, o’zi reaksiya mahsulotlari tarkibiga kirmaydigan moddalar katalizatorlar deyiladi. Kataliz uch xil: 1) gomogen, 2) geterogen, 3) fermentativ. Gomogen : katalizator va reaksiyaga kirishuvchi moddalar bitta fazada (gaz yoki suyuq) bo’ladi. Masalan: H 2 SO 4(s) CH 3 COOH (s)+ C 2 H 5 OH(s) CH 3 COOC 2 H 5(s) + H 2 O (s)

Kislota, asos, tuzlar (Cr, Mn, Fe, Co, Ni) eritmalari gomogen kataliz. Gomogen katalizga H 2 O 2 ni Cr 2 O 72 -, WO 42 -, Mo. O 42 - ishtirokida H 2 O va O 2 ga parchalanishi. Gomogen katalizga kompleks hosil b’olishi, oks. qayt. reaksiyalari, gidrogenlash, sulfirlash, kislota va asoslarning o’zaro ta’siri kiradi. Faqat gazlar ishtirokida amalga oshadigan reaksiyalar ham gomogen kataliz hisoblanadi: NO 2(g) 2 SO 2(g) + O 2(g) 2 SO 3(g) Geterogen : katalizator va reaksiyaga kirishuvchi moddalar turli xil fazalarda. Masalan: Fe (k) Mn. O 2(k) N 2(g) + 3 H 2(g) 2 NH 3(g) 2 H 2 O 2(s) 2 H 2 O (s) + O 2(g)

HNO 3, H 2 SO 4, NH 3 olinishi, dori moddalar olinishi Katalizatorlar Mn(IV), Ni, Co, Fe, Al. Cl 3, Zn. Cl 2, Ti. O 2 i. Fermentlar biologik katalizatorlar , organizmda modda almashinuvini boshqaradi. Harorat, bosim, eritma muhiti (p. H)ning ta’siriga juda sezgir. 10000 dan ortiq turli biokimyoviy reaksiyalarga ta’sir etadi. Saxarozaning oksidlanishi fermentlar ishtirokida million marta tezlashadi. Pepsin, tripsin, ribonukleaza, ureaza kabi ko’plab fermentlar kristall holda ajratib olingan. 1. A + B [ A. . . B ] AB Faollashgan kompleks 2. A + K [ A. . . K ] AK + B [ AK. . . B ] AB + K faollashgan oraliq kompleks

Katalizatornning reaksiya tezligiga ta’siri: H 2+I 2=2 HI Katalizatorsiz Ea=168 k. J/mol; katalizator(Au) Ea=105 k. J/mol, katalizator (Pt) Ea=59 k. J/mol. Katalizator reaksiyaning issiqlik effektini o’zgartirmaydi. To’g’ri va teskari reaksiyalarni bir xilda tezlashtirib muvozanat hosil bo’lishini jadallashtiradi.

Kimyoviy muvozanat qaytar va qaytmas reaksiyalar Faqat bir yo’nalishda boradigan reaksiyalar qaytmas reaksiyalar deyiladi. Qaytmas reaksiyada ko’p miqdorda issiqlik ajralib chiqsa, gaz modda, cho’kma yoki oz dissotsilanadigan moddalar: CH 4 + 2 O 2 = CO 2 + 2 H 2 O + Q Mg + 2 HCl = Mg. Cl 2 + H 2 Ag. NO 3 + Na. Cl = Ag. Cl + Na. NO 3 Na. OH + HNO 3 = Na. NO 3 + H 2 O Ikki qarama-qarshi yo’nalishda boradigan reaksiyalar qaytar reaksiyalar deyiladi. N 2 + 3 H 2 2 NH 3 ; a. A + b. B c. C + d. D V 1=k 1[A]a*[B]b V 2=k 2[C]c*[D]d V 1=V 2 [C]c*[D]d K=----- [A]a*[B]b
![A B C D muvozanat konsentratsiyalari a b c d reaksiya tenglamasining [A], [B], [C], [D] – muvozanat konsentratsiyalari; a, b, c, d- reaksiya tenglamasining](https://slidetodoc.com/presentation_image_h/1f63266b8aade999009834cc8f0add64/image-20.jpg)
[A], [B], [C], [D] – muvozanat konsentratsiyalari; a, b, c, d- reaksiya tenglamasining stexeometrik koeffisientlari; K – muvozanat konstantasi , u haroratga bog’liq. Moddalarning muvozanat vaqtidagi konsentratsiyalari muvozanat konsentrasiyasi deyiladi. N 2 + 3 H 2 2 NH 3 V 1=k 1[N 2]1*[H 2]3; V 2=k 2[NH 3]2 K=k 1/k 2 [NH 3]2 K= ------- [N 2]1*[H 2]3 Muvozanat holatida reaksiya mahsulotlari konsentrasiyalari ko’paytmasining dastlabki moddalar konsentrasiyalari ko’paytmasiga nisbati doimiy son bo’lib, muvozanat konstantasi deyiladi.

K moddalarning tabiatiga, haroratga bog’liq, konsentratsiyaga, bosimga va katalizatorga bog’liq emas. Geterogen reaksiyalarda: 3 Fe (k) +4 H 2 O (g) = Fe 3 O 4(k) +4 H 2(g) [H 2]4 K = ------- [H 2 O]4 Muvozanat konstantasi izobarik izotermik potensial : Go= - RT ln K Go kichik bo’lishi uchun K katta bo’lishi kerak.

Le-Shatele prinsipi. muvozanatda turgan sistemaga biron-bir tashqi ta’sir ko’rsatilsa, muvozanat shu ta’sirni kamaytiruvchi reaksiyaning borishi tarafiga siljiydi. N 2 + 3 H 2 = 2 NH 3 H < 0
 Parallel reaksiyalar
Parallel reaksiyalar Sikllar
Sikllar Konstruksiya turlari
Konstruksiya turlari Mashinasozlik texnologiyasi maruza matni
Mashinasozlik texnologiyasi maruza matni Nutqning tovush madaniyati
Nutqning tovush madaniyati Ta'lim metodlarining mohiyati
Ta'lim metodlarining mohiyati Ta'limni tashkil etish shakllari slayd
Ta'limni tashkil etish shakllari slayd Badiiy asarlarni sahnalashtirish
Badiiy asarlarni sahnalashtirish Nuklein kislotalar slayd
Nuklein kislotalar slayd Nana texnologiyasi
Nana texnologiyasi Aromatik karbon kislotalar
Aromatik karbon kislotalar Bakteriya hujayrasi
Bakteriya hujayrasi Oksidlar turlari
Oksidlar turlari Spirtlarning fizik xossalari
Spirtlarning fizik xossalari Anionli kompleks birikmalar
Anionli kompleks birikmalar Chumoli kislota strukturasi
Chumoli kislota strukturasi Korroziya va uning turlari
Korroziya va uning turlari Materiallarning fizik va kimyoviy xossalari
Materiallarning fizik va kimyoviy xossalari Termokimyoviy tenglamalar
Termokimyoviy tenglamalar Kremniyning olinishi
Kremniyning olinishi Kimyoviy qotuvchi kompozit plombalar
Kimyoviy qotuvchi kompozit plombalar