2 Chapter 2 Molecular Structure Definition of chemical



































- Slides: 74

第 2章 分子结构 Chapter 2 Molecular Structure


本章教学内容 Definition of chemical bonding 2. 1 化学键的定义 2. 2 共价键的概念与路易斯 Concept of the covalent bond theory and Lewis’ structure 结构式 formula 2. 3 用以判断共价分子几何形 状的价层电子对互斥理论 2. 4 原子轨道的重叠 — 价键 理论 2. 5 2. 6 2. 7 2. 8 共轭大π键 等电子体原理 分子轨道理论 共价分子的性质 2. 9 分子间作用力和氢键 VSEPR for judging the configuration of the covalence molecular Superposition of atomic orbital — valence bond theory Molecular orbital theory Metallic bond theory Intermolecular forces and hydrogen bonding




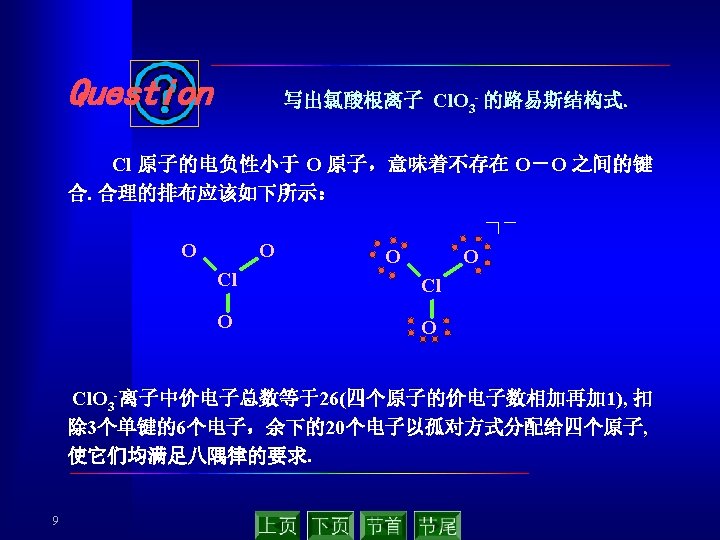
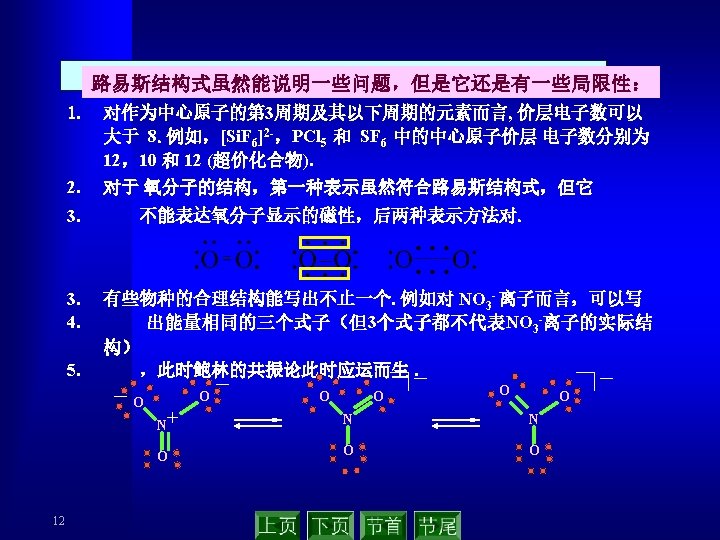
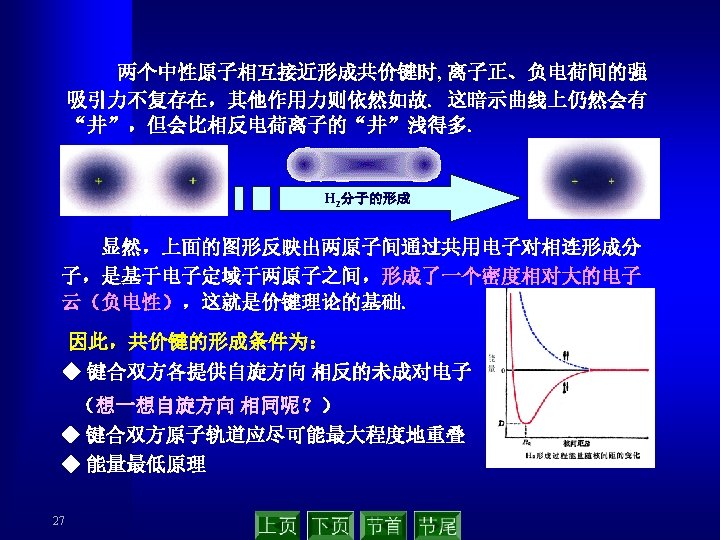
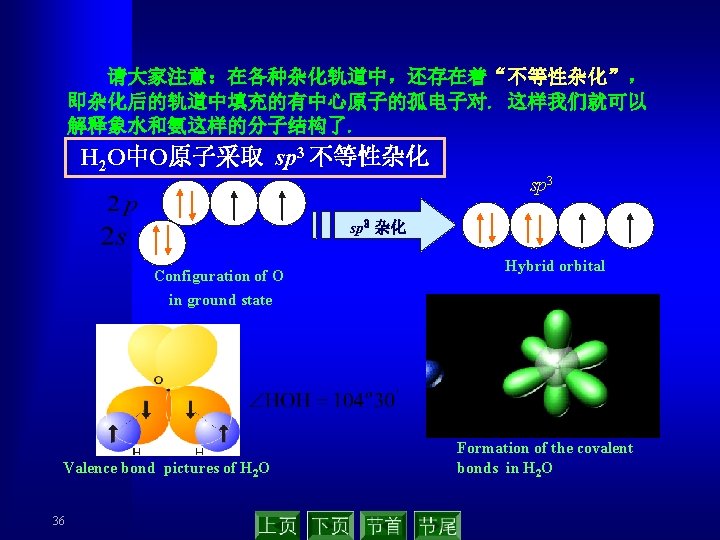
2. 2 共价键的概念与路易斯结构式 (covalent bond theory ) 2. 2. 1 共价键的相关概念 Lewis G. N. 在 1916年假定化学键所涉及的每一 对电子处于两个相邻原子之间为其共享,用A—B表示. 双键和叁键相应于两对或三对共享电子. 分子的稳定性是因为共享 single covalent bond 电子对服从“八隅律”(octet rule). double covalent bond 共享电子对——共价键 记住有关术语和概念! 配位共价键 coordination covalent bond 极性共价键 polar covalent bond 非极性共价键 non polar covalent bond 电正性原子 electropositive atom 电负性原子 electronegative atom 7 triple covalent bond The bond polarity in the hydrogen halide Chemical H – I bond Electronicgrativity difference Bonding polarity 0. 46 H – Br H – Cl 0. 76 0. 96 Increasing in turn H– F 1. 78








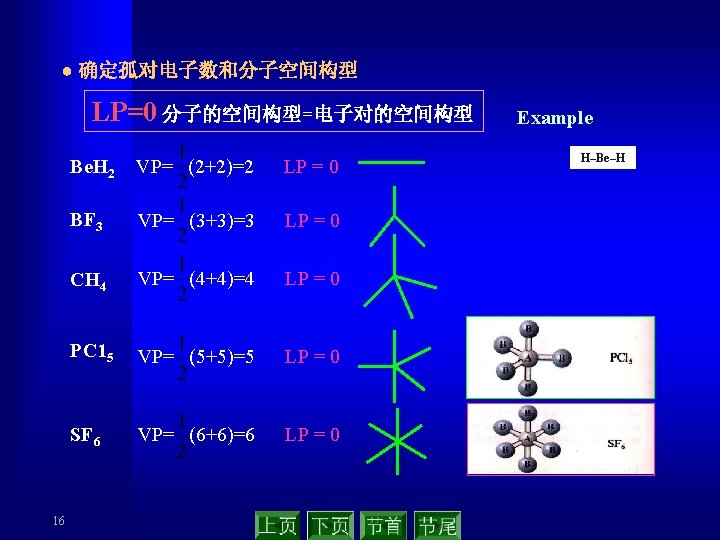
● 确定电子对的空间排布方式 Geometry of covalent molecules with no unshared electron pairs on the central atom Arrangement of B atoms Shared Formula Structures relative to A atoms(ideal BAB type electron pair bond angle) AB 2 AB 3 2 3 Linear B—A—B (180°) B Triangular planar A AB 4 4 Tetrahedral B (109° 28’) AB 5 AB 6 5 6 Triangular bipyramidal* (Ba. ABa, 180°) (Be. ABe, 120°) (Be. ABa, 90° Octahedral (90°, 180°) 15 BB B (120°) B A B B B



18



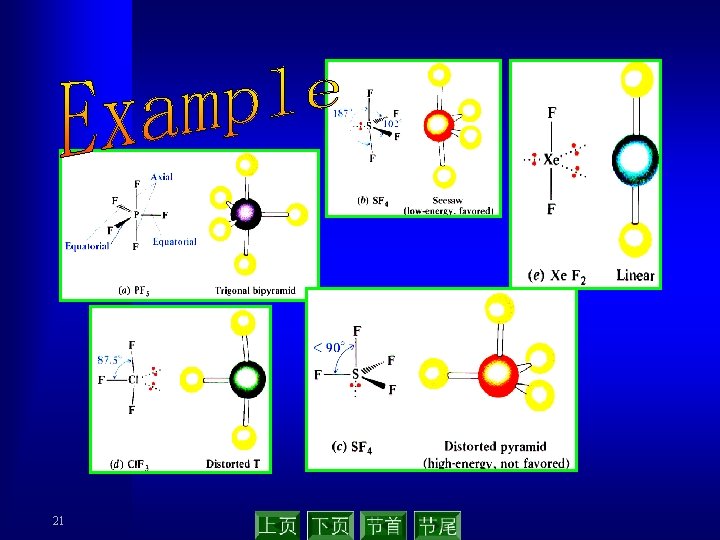
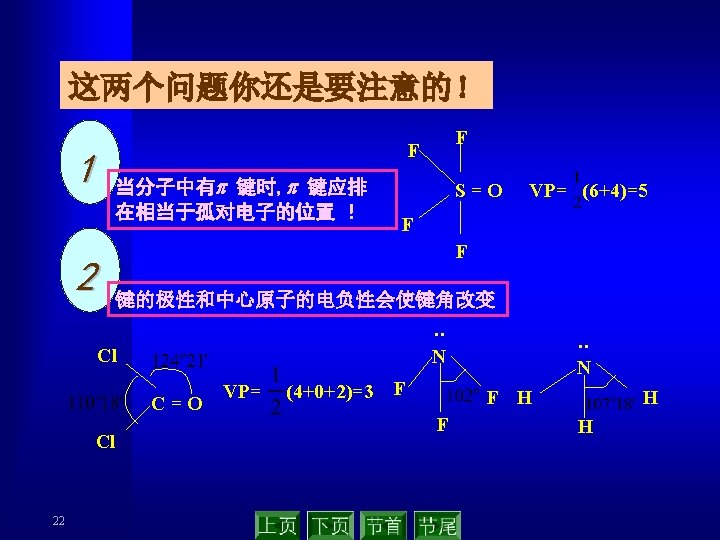
21












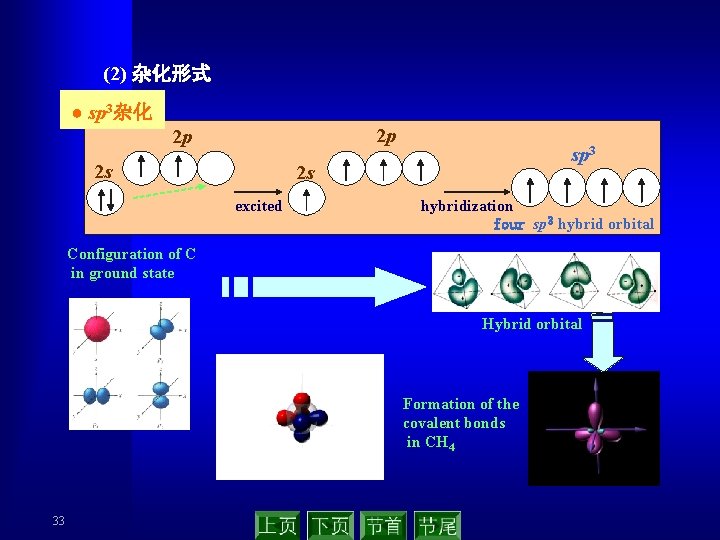
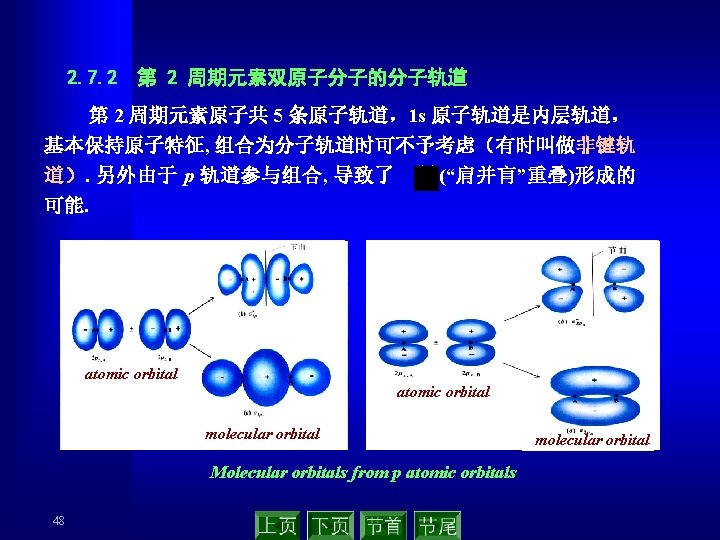
(2) 杂化形式 ● sp 3杂化 2 p 2 p 2 s sp 3 2 s excited hybridization four sp 3 hybrid orbital Configuration of C in ground state Hybrid orbital Formation of the covalent bonds in CH 4 33

● sp 2杂化 2 p 2 p 2 s sp 2 2 s excited 2 s 2 p轨道 hybridization three sp 2 hybrid orbital Configuration of B in ground state Hybrid orbital Formation of the covalent bonds in BCl 3 34

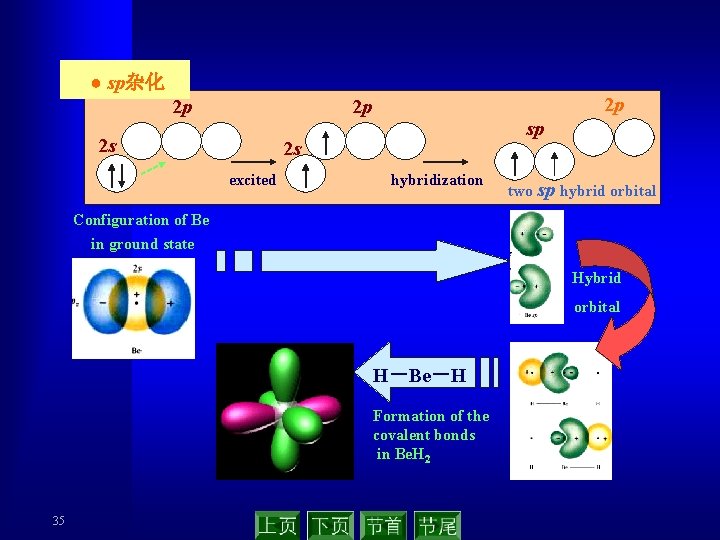
● sp杂化 2 p 2 p 2 p 2 s sp 2 s excited hybridization two sp hybrid orbital Configuration of Be in ground state Hybrid orbital H-Be-H Formation of the covalent bonds in Be. H 2 35


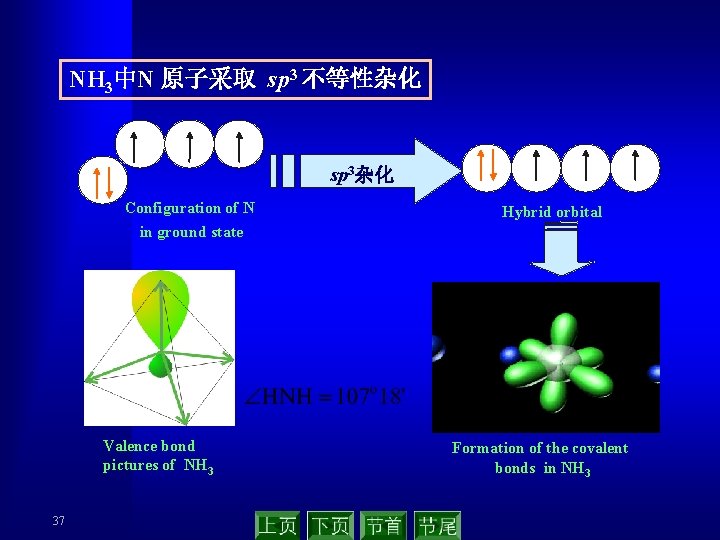
NH 3中N 原子采取 sp 3 不等性杂化 sp 3杂化 Configuration of N Hybrid orbital in ground state Valence bond pictures of NH 3 37 Formation of the covalent bonds in NH 3


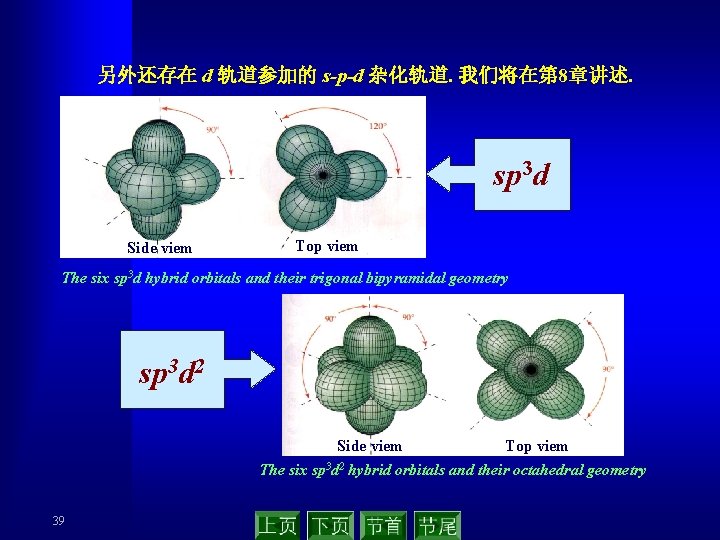
另外还存在 d 轨道参加的 s-p-d 杂化轨道. 我们将在第 8章讲述. sp 3 d Side viem Top viem The six sp 3 d hybrid orbitals and their trigonal bipyramidal geometry sp 3 d 2 Side viem Top viem The six sp 3 d 2 hybrid orbitals and their octahedral geometry 39


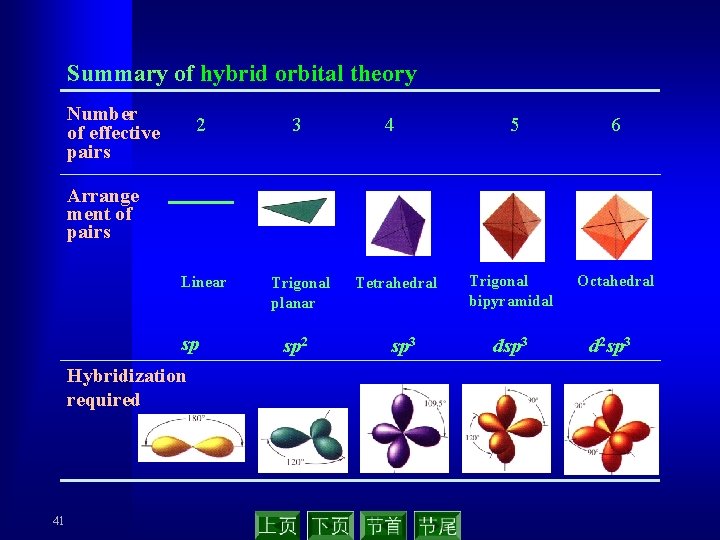
Summary of hybrid orbital theory Number of effective pairs 2 3 Linear Trigonal planar 4 5 6 Trigonal bipyramidal Octahedral Arrange ment of pairs sp Hybridization required 41 sp 2 Tetrahedral sp 3 d 2 sp 3








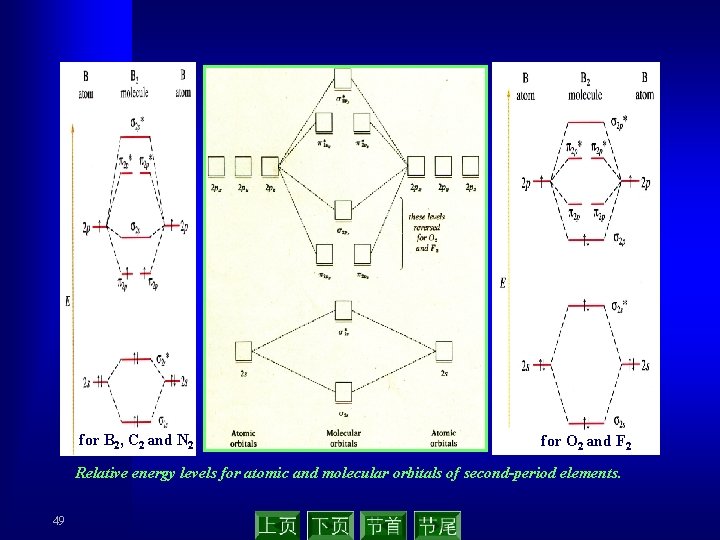
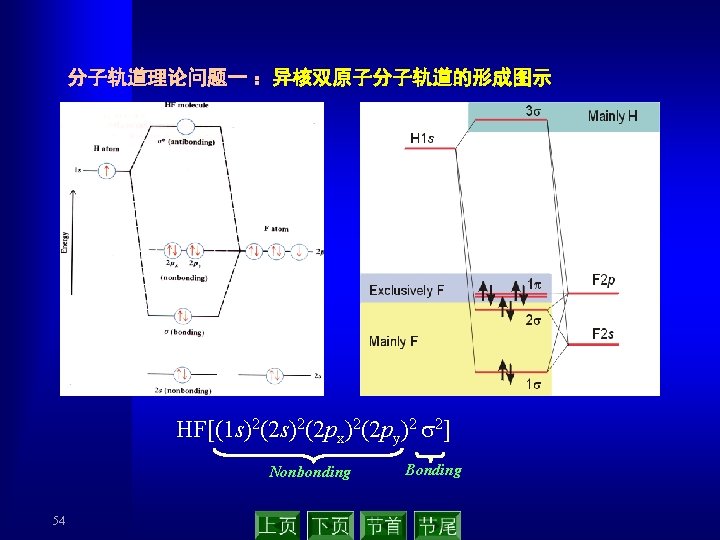
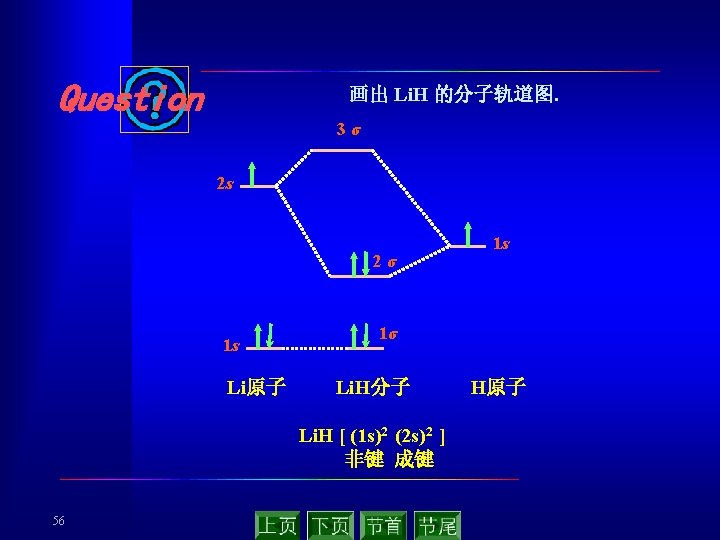
for B 2, C 2 and N 2 for O 2 and F 2 Relative energy levels for atomic and molecular orbitals of second-period elements. 49




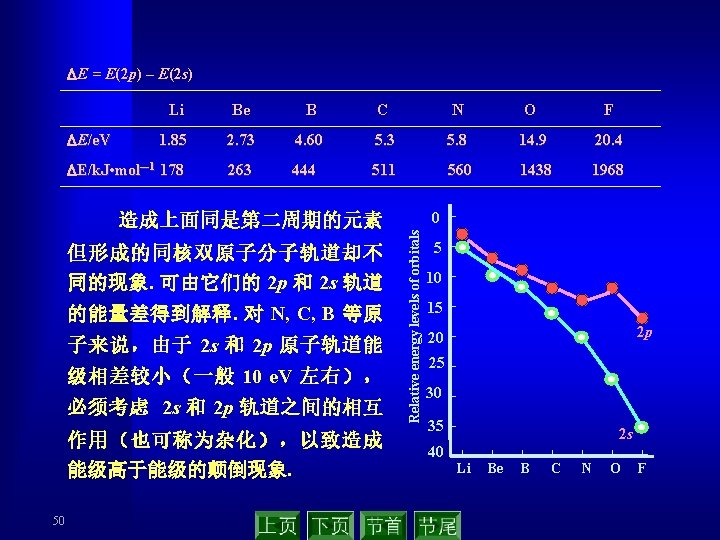
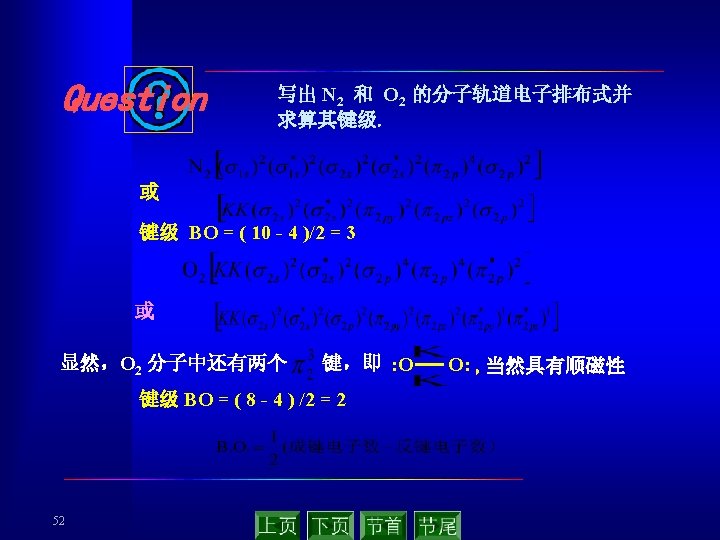
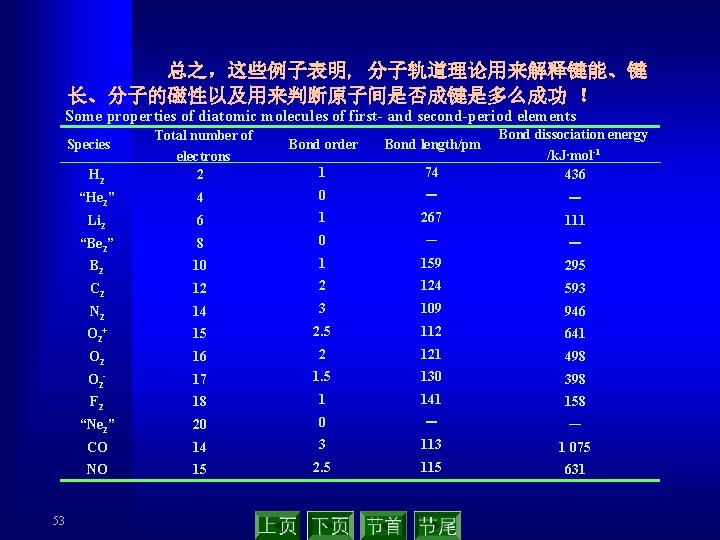
总之,这些例子表明, 分子轨道理论用来解释键能、键 长、分子的磁性以及用来判断原子间是否成键是多么成功 ! Some properties of diatomic molecules of first- and second-period elements 53 Bond order Bond length/pm 1 74 Bond dissociation energy /k. J·mol-1 436 H 2 Total number of electrons 2 “He 2” 4 0 - - Li 2 6 1 267 111 “Be 2” 8 0 - - B 2 10 1 159 295 C 2 124 593 N 2 14 3 109 946 O 2+ 15 2. 5 112 641 O 2 16 2 121 498 O 2 - 17 1. 5 130 398 F 2 18 1 141 158 “Ne 2” 20 0 - - CO 14 3 113 1 075 NO 15 2. 5 115 631 Species
















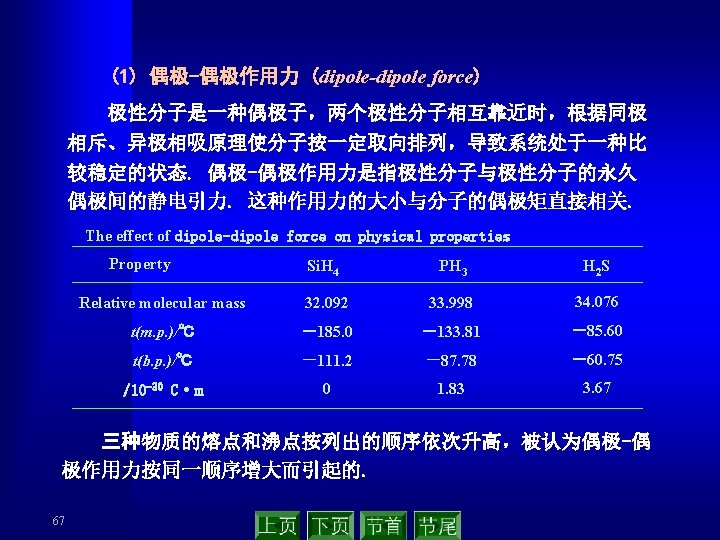
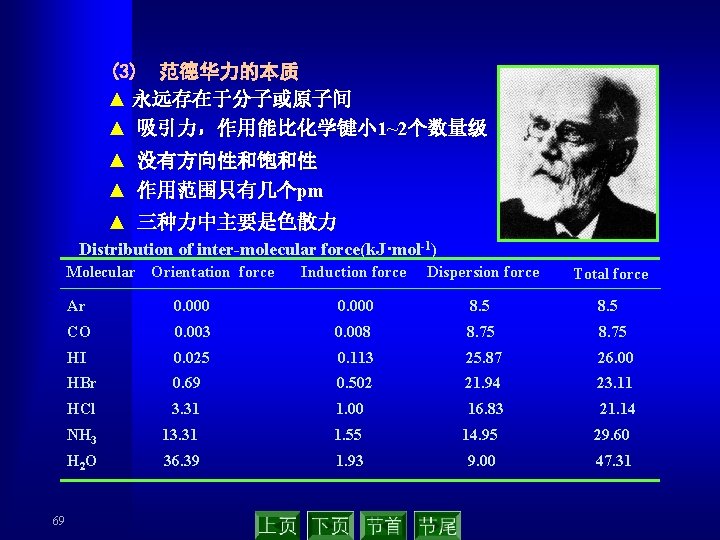
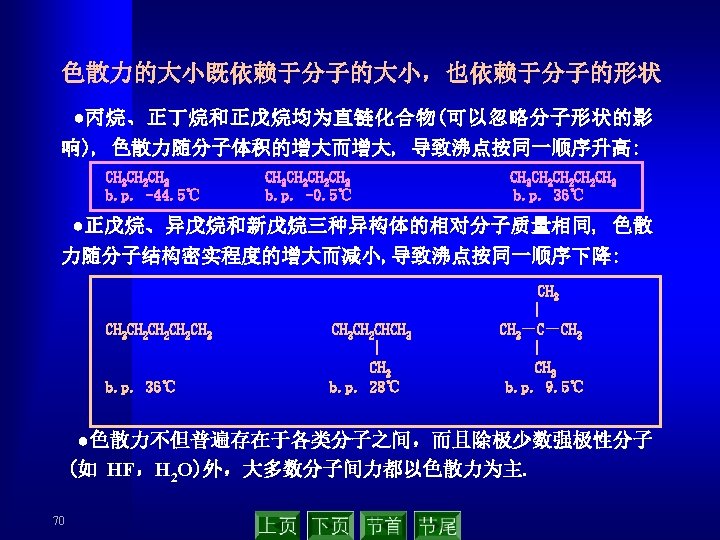
(3) 范德华力的本质 ▲ 永远存在于分子或原子间 ▲ 吸引力,作用能比化学键小 1~2个数量级 ▲ 没有方向性和饱和性 ▲ 作用范围只有几个pm ▲ 三种力中主要是色散力 Distribution of inter-molecular force(k. J·mol-1) Molecular Orientation force 69 Induction force Dispersion force Total force Ar 0. 000 8. 5 CO 0. 003 0. 008 8. 75 HI 0. 025 0. 113 25. 87 26. 00 HBr 0. 69 0. 502 21. 94 23. 11 HCl 3. 31 1. 00 16. 83 21. 14 NH 3 13. 31 1. 55 14. 95 29. 60 H 2 O 36. 39 1. 93 9. 00 47. 31




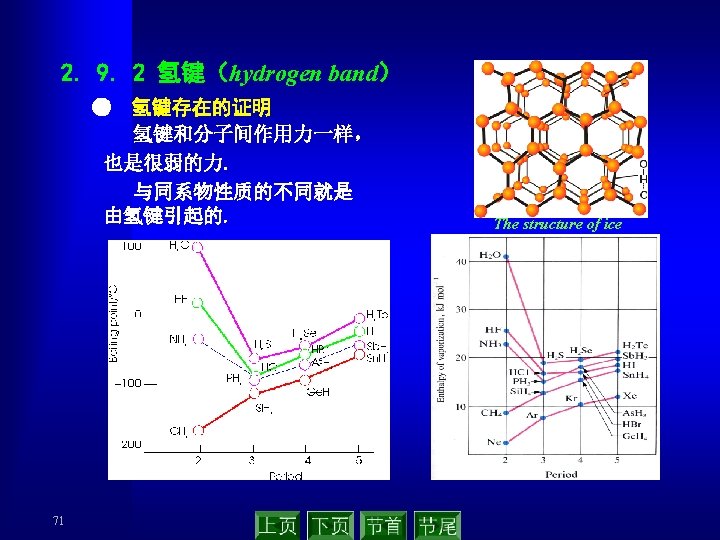
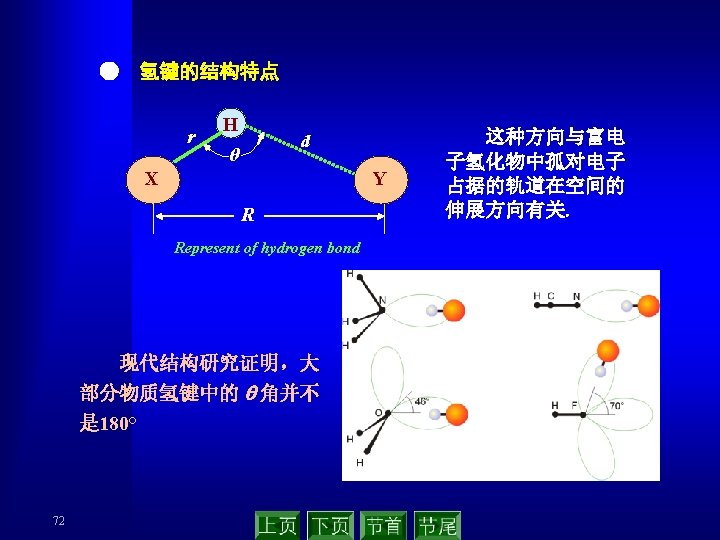
● 氢键的类型 ▲ 有非对称和对称之分 ▲ 有分子内和分子间之分 ▲ 有强弱之分(与元素的电负性有关) Typical values for the enthalpies of dissociation of different types of hydrogen bonds Category Hydrogen bond Approximate dissociation enthalpy/ k. J mol-1 Asymmetrical F—H……FH 29 Asymmetrical HO—H……OH 2 25 Asymmetrical H 2 N—H……NH 3 17 Asymmetrical HS—H……SH 2 7 Symmetrical F……H……F 165 ● 氢键对化合物性质的影响 ▲ m. p. ,b. p. O–H · · ·O ▲ 粘度 ▲ 酸性 ▲ 化学反应性 73 Na+ O-C C–O– Na+ O · · ·H – O
