2 3 La masse molaire La masse atomique











- Slides: 12

2. 3 La masse molaire • La masse atomique • Les atomes sont infiniment petits et leur masse s’exprime en ______ Unité de masse atomique (uma) ou (u) • Ex : 27 u un atome d’aluminium _____ 40 u un atome de calcium _______ un atome d’or : _____ 197 u un atome de fer : _______ 56 u

• La masse moléculaire • Les molécules sont aussi infiniment petites et Unité de masse leur masse s’exprime en _______ atomique (uma ou u) Ex : une molécule d’eau (H 2 O) 1 u • [H (____) x 2] + [O (____)] = _____ 16 u 18 u une molécule de dioxyde de carbone (CO 2) 12 u 16 u 44 u [C (____)] + [O (____) x 2] = _____ une molécule d’ammoniac (NH 3) [N 14 u (____)] + [H (____) x 3] = _____ 1 u 17 u •

• La masse molaire (M) • Une mole, c’est 6. 02 x 1023 particules. C’est un nombre de particules très grand, alors la masse s’exprime par une unité plus grand que le uma. g g / mol On l’exprime en ______ ou ______ • Ex : 27 g une mole d’aluminium _____ 40. 1 g une mole de calcium _______ 197 g une mole d’or : _____ une mole de fer : _______ 55. 8 g

• Étant donné que Une mole, c’est 6. 02 x 1023 particules, les particules peuvent être des atomes ou des molécules, alors : • Une mole de molécule d’eau (H 2 O) 1 g 16 g 18 g [H (____) x 2] + [O (____)] = ____ • Une mole de molécule de dioxyde de carbone(CO 2) [C (____)] + [O (____) x 2] = _____ 12 g 16 g 44 g • Une mole de molécule d’ammoniac (NH 3) 1 g [N (____)] + [H (____) x 3] = _______ 14 g 17 g

• La relation entre la masse atomique et la masse molaire • La masse d’un atome s’exprime en _____. La uma masse d’une mole (6. 02 x 1023 particules) g s’exprime en ___. La grandeur de la valeur exprimée en uma et celle exprimée en grammes est la même. •

• Détermination de la masse molaire d’un composé • • Pour trouver la masse molaire d’un composé, tu as besoin de la formule du composé et de la masse atomique de chaque élément qui le compose. Tu dois tenir compte de la quantité de chaque atome dans le composé.

• Exemple : Calcule la masse molaire de 1 mol de phosphate de calcium, Ca 3(PO 4)2. • • Ca : _____ g X 3 = _______ 40. 1 120. 3 g • P : _____ g x __ = _______ 31 2 62 g • O : _____ g x __ = _______ 16 8 128 g • 310. 3 g • Masse molaire (M): _____

• Exercices page 184 # 23 à 26

Conversion du nombre de moles en masse • Une fiole contient 0. 75 moles de CO 2. Quelle est la masse de cet échantillon de CO 2 ? (Ce qu’on cherche c’est combien de grammes de CO 2) 0. 75 moles de CO 2 x 44 g de CO 2 = 33. 0 g de CO 2 1 mole Valeur à convertir Facteur d’équivalence 44 g = 1 mole Valeur recherchée

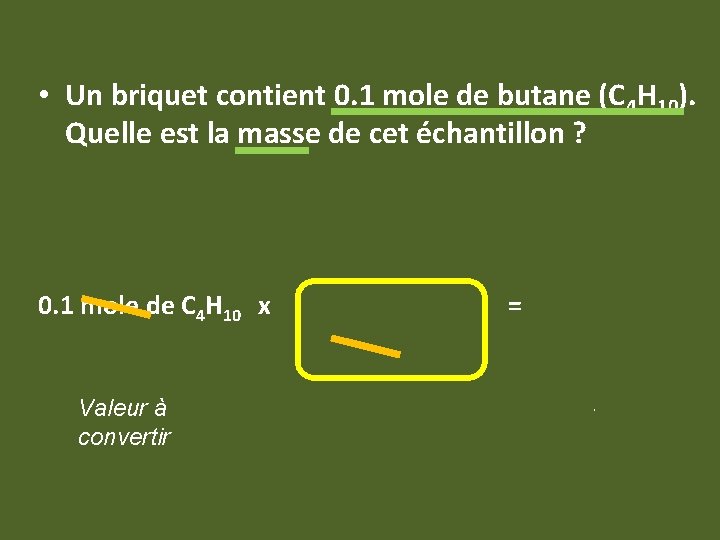
• Un briquet contient 0. 1 mole de butane (C 4 H 10). Quelle est la masse de cet échantillon ? 0. 1 mole de C 4 H 10 x 58 g de CO 2 = 5. 8 g de C 4 H 10 1 mole Valeur à convertir Facteur d’équivalence 58 g = 1 mole Valeur recherchée

Conversion des masses en moles • Combien y a-t-il de moles d’ammoniac, NH 3, dans 76. 5 g d’ammoniac ? (Ce qu’on cherche c’est combien de moles d’ammoniac. ) 76. 5 g de NH 3 x 1 mole = 4. 5 mole de NH 3 17 g de NH 3 Valeur à convertir Facteur d’équivalence 17 g = 1 mole Valeur recherchée

• Combien y a-t-il de moles de d’eau, H 2 O, dans une cuillérée à soupe (15 g) de ce liquide ? (Ce qu’on cherche c’est combien de moles d’eau. ) 15 g de H 2 O x 1 mole 18 g de H 2 O Valeur à convertir = 0. 83 mole de H 2 O Facteur d’équivalence 18 g = 1 mole Valeur recherchée