1Notasi Penulisan partikel sub Atom Notasi atom ialah

1)Notasi Penulisan partikel sub Atom Notasi atom ialah cara penulisan sub atom dalam atom. Penulisan lambang atom X dengan nomor atom (Z) dan massa atom (A) adalah : (jika ditulis dalam tabel periodik) dimana X = lambang atom suatu unsur Z = nomor atom Z = jumlah proton (p) Z = jumlah elektron (e-) untuk atom (netral) A = nomor massa A = jumlah proton (p) + jumlah neutron (n)

Teori Atom Bohr mengungkapkan sebagai berikut : • Elektron dengan jumlah energi tertentu akan tetap ada pada tingkat energi tertentu. • Elektron dapat pindah dari tingkat energi yang satu ke yang lain dengan melepaskan energi.

Berdasarkan teori atom Rutherford dan teori kuantum Planck, Bohr mengajukan postulat tentang model atom, yaitu: 1). Elektron-elektron dalam suatu atom mengelilingi inti pada lintasan tertentu yang disebut lintasan stasioner. Pada lintasan ini, elektron tidak menyerap atau melepaskan energi. 2). Elektron akan melepaskan elektron tersebut berpindah ke tingkat energinya, dan elektron berpindah ke lintasan dengan (lintasan lebih luar). energi (berupa foton) jika lintasan yang lebih rendah akan menyerap energi jika tingkat energi lebih tinggi
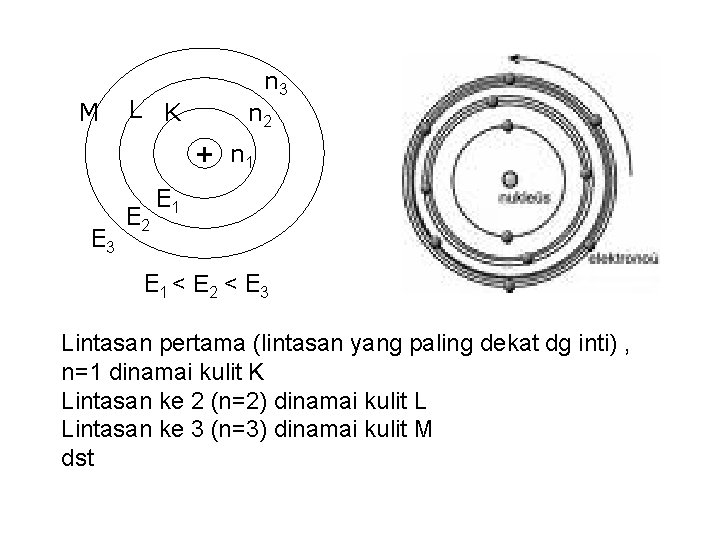
M L K n 3 n 2 + n 1 E 3 E 2 E 1 < E 2 < E 3 Lintasan pertama (lintasan yang paling dekat dg inti) , n=1 dinamai kulit K Lintasan ke 2 (n=2) dinamai kulit L Lintasan ke 3 (n=3) dinamai kulit M dst

Atom tersusun Inti atom proton & netron Kulit atom elektron. Notasi penulisan partikel penyusun atom A X Z X = Lambang atom Z = nomor atom = jumlah proton A = massa atom = jumlah proton + netron

26 Fe 56 proton =26 massa atom Fe = 56 netron = 56 -26 = 30 elektron = 26 ( atom bersifat netral, artinya jumlah proton= elektron) Ion positif atom yang bermuatan positif atom melepaskan elektron jumlah p > e Ion negatif atom yang bermuatan negatif atom menangkap elektron jumlah e > p
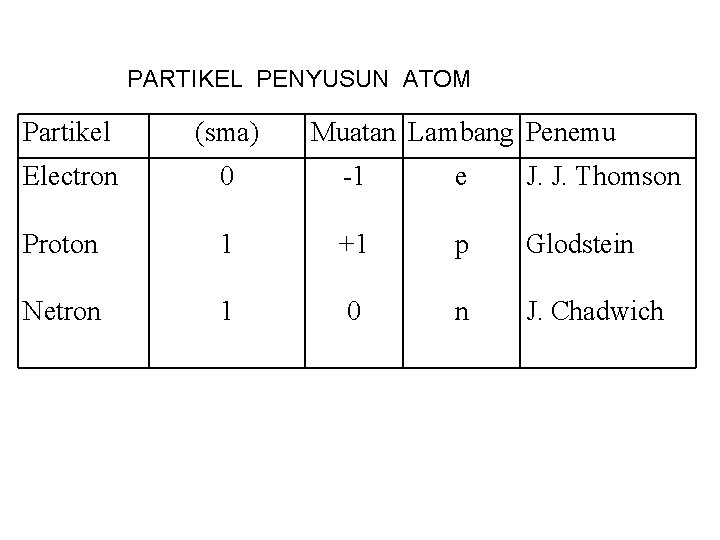
PARTIKEL PENYUSUN ATOM Partikel (sma) Muatan Lambang Penemu Electron 0 -1 e J. J. Thomson Proton 1 +1 p Glodstein Netron 1 0 n J. Chadwich

Atom netral p = e n=A–p Ion positif Contoh: z Atom yang melepaskan elektron, AX+a p > e atau e < p atom X melepaskan elektron sebanyak a elektron p=z e=p–a n=A–p Ion negatif z AX-b Atom menangkap elektron, e > p atom X menangkap elektron sebanyak b elektron p=z e=p+b n=A–p

Atom netral p = e n=A–p Ion positif Atom yang melepaskan elektron, Contoh: 2656 Fe 3+ p > e atau e < p atom Fe melepaskan 3 elektron p = 26 e = 26 – 3 = 23 n = 56 – 26 = 30 Ion negatif 8 Atom menangkap elektron, e > p 16 O 2 - atom O menangkap 2 elektron p=8 e = 8 + 2 = 10 n = 16 – 8 =8
![p=Z e=Z n = (A – Z) Notasi atom netral Contoh : [1] Atom p=Z e=Z n = (A – Z) Notasi atom netral Contoh : [1] Atom](http://slidetodoc.com/presentation_image_h2/4651b43dd789b152cd053c0dec7e1b9c/image-10.jpg)
p=Z e=Z n = (A – Z) Notasi atom netral Contoh : [1] Atom Lithium memiliki 3 elektron, 3 proton, dan 4 neutron [2] Atom Natrium memiliki 11 elektron, 11 proton, dan 12 neutron

Latihan Soal : Tentukan jumlah proton, elektron dan neutron dari atom-atom berikut ! p= [a] [b] [c] [d] [e] p= e= n= p= e= n= [f] [g] e= n= p= e= n= [h] [i] [j] p= e= n=

Latihan Soal : Tentukan jumlah proton, elektron dan neutron dari atom-atom berikut ! p=6 p=9 [f] e=6 e = 9+ 1 = 10 [a] n = 12 – 6 = 6 [b] n = 19 – 9 = 10 p = 35 [g] e = 35 n = 80 – 35 = 45 p = 13 [c] e = 13 – 3 = 10 n = 27 – 13 = 14 [h] [i] [d] [j] p = 19 e = 19 - 1 = 18 [e] n = 39 – 19 = 20

Istilah Isotop berbeda (jumlah netron berbeda) Contoh : Isobar : Unsur-unsur berbeda (jumlah proton berbeda) tetapi massa atom sama. Contoh : Isoton : Unsur-unsur berbeda dengan jumlah netron sama Contoh : Isoelektron : unsur atau ion-ion yang jumlah elektron sama. Contoh :
- Slides: 13