12 Introduccin al estudio de las Protenas Introduccin














- Slides: 22

12. Introducción al estudio de las Proteínas

Introducción al estudio de las proteínas Mulder (1838): Describe un material presente en todos los seres vivos, con la siguiente composición porcentual en peso: C: 55 % H: 6. 5 % O: 22 % N: 15 % S: 0. 5 % Dado el contenido en azufre (0. 5 %) el peso molecular mínimo de dicho material debería ser 32*100/0. 5 = 6400

Hoppe-Seyler (1864): Cristalizó por primera vez una proteína, la hemoglobina La hemoglobina cristalizada contiene invariablemente un 0. 35 % de hierro. Aplicando el razonamiento de Mulder, el peso molecular mínimo de la hemoglobina será de 100*55. 8/0. 35 = 15942 (aprox. 16000) Posteriormente se ha determinado que en la hemoglobina hay cuatro átomos de hierro; por tanto su peso molecular es de aprox. 64000

Las proteínas son susceptibles de hidrólisis ácida: HCl 6 N, 90ºC, 18 horas En el hidrolizado aparecen aminoácidos, compuestos que contienen una función amino -NH 2 y una función carboxilo, -COOH En las proteínas hay 20 aminoácidos distintos: los llamados aminoácidos proteicos Hay asimismo muchos otros aminoácidos que no forman parte de proteínas, los aminoácidos no proteicos Con frecuencia los aminoácidos proteicos aparecen modificados: son las modificaciones postraduccionales

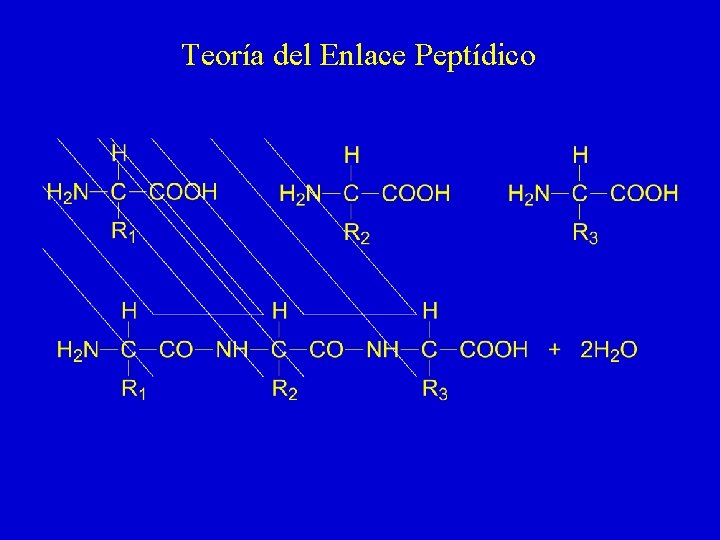
Teoría del Enlace Peptídico


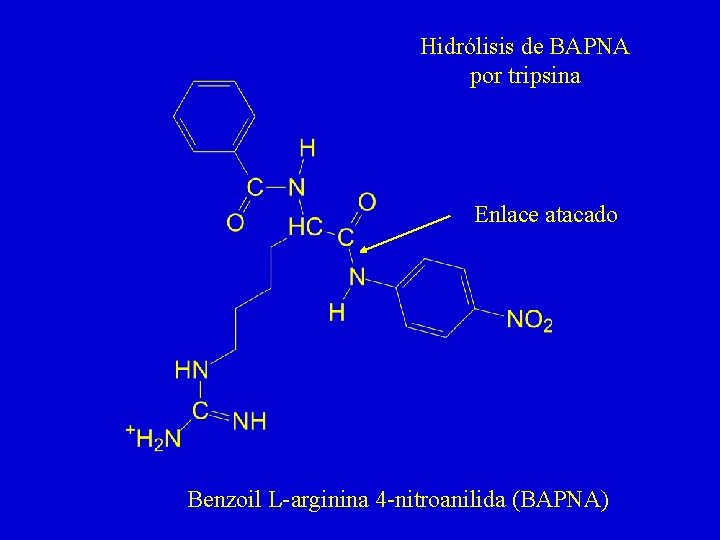
Teoría del Enlace Peptídico - Pruebas experimentales, 1 1. Las proteínas nativas tienen relativamente pocos grupos ácido-base titulables. A medida que progresa su hidrólisis, van apareciendo grupos -NH 2 y -COOH en cantidad equimolar 2. En hidrolizados parciales se encuentran di- y tripéptidos cuya estructura puede determinarse directamente 3. Las enzimas que hidrolizan proteínas (tripsina, quimotripsina, pepsina, papaína) atacan al enlace -CO-NH-, tal como puede observarse en compuestos sintéticos (p. e. BAPNA) 4. Las proteínas dan positiva la reacción de biuret

Hidrólisis de BAPNA por tripsina Enlace atacado Benzoil L-arginina 4 -nitroanilida (BAPNA)

Teoría del enlace peptídico - Pruebas experimentales, 2 5. Espectro infrarrojo: banda característica de enlace C-N que desaparece con la hidrólisis de la proteína 6. Cristalografía de rayos X: determinación de la estructura 7. Síntesis completa de ribonucleasa

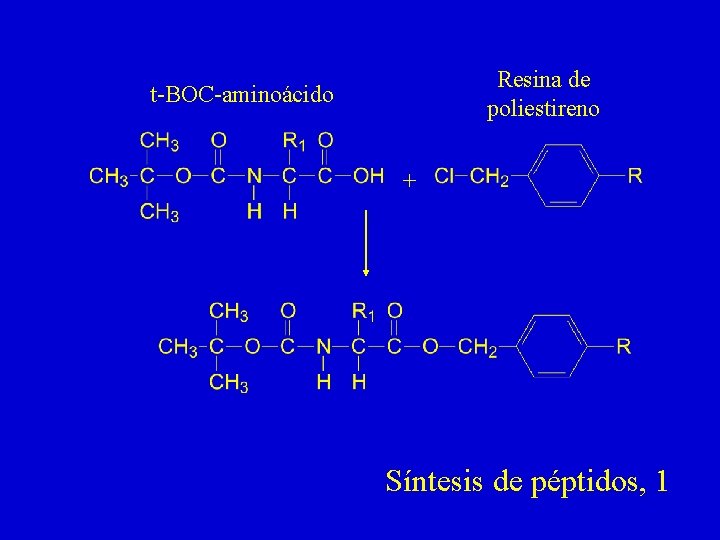
Resina de poliestireno t-BOC-aminoácido + Síntesis de péptidos, 1

+ Síntesis de péptidos, 2

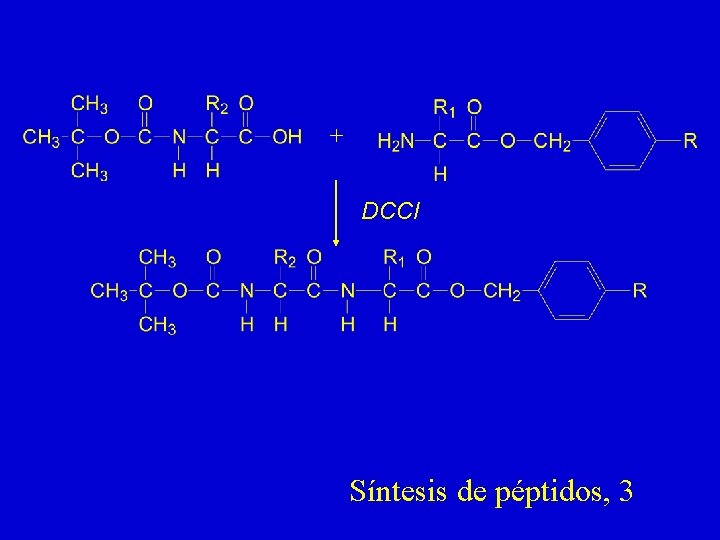
+ DCCI Síntesis de péptidos, 3

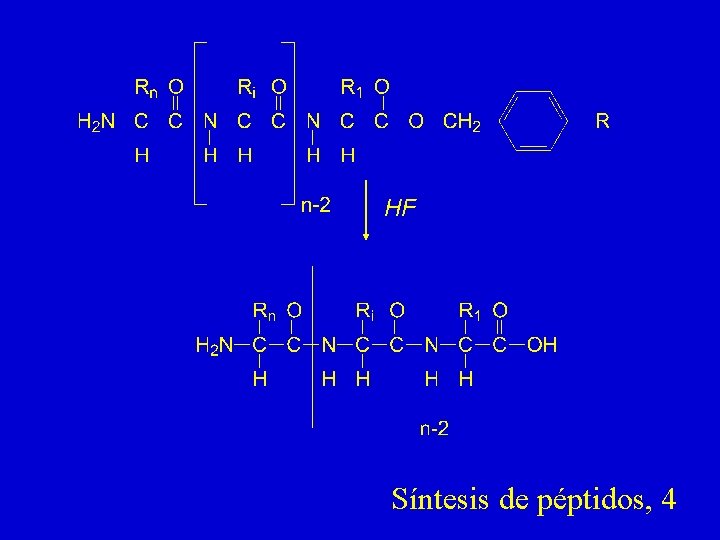
HF Síntesis de péptidos, 4


Funciones biológicas de las proteínas - Biocatalizadores (enzimas) - Receptores de señales químicas - Transportadores - Estructurales (citoesqueleto, colágeno) - Defensa (inmune, restricción bacteriana, etc. ) - Motilidad (motores moleculares) - Transducción - Adherencia celular y organización tisular - Plegamiento correcto de otras proteínas - Otras: anticongelante

Interacción estereoquímica, 1 Aglutinina de Galanthus nivalis con su ligando, un manopiranósido

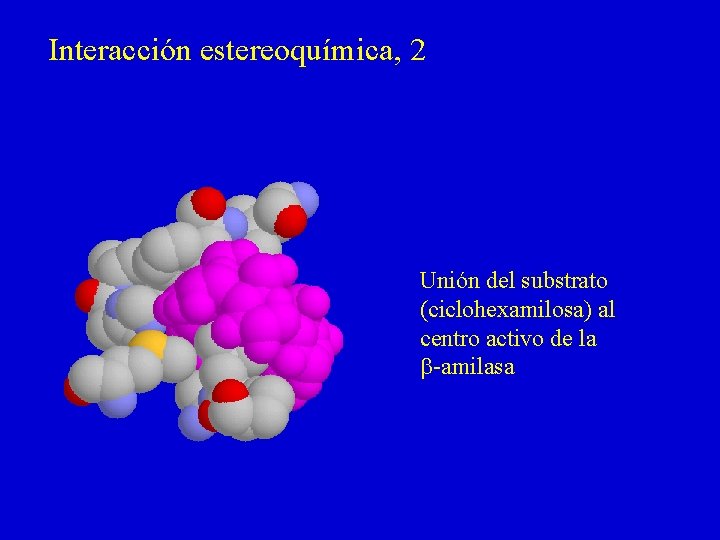
Interacción estereoquímica, 2 Unión del substrato (ciclohexamilosa) al centro activo de la b-amilasa

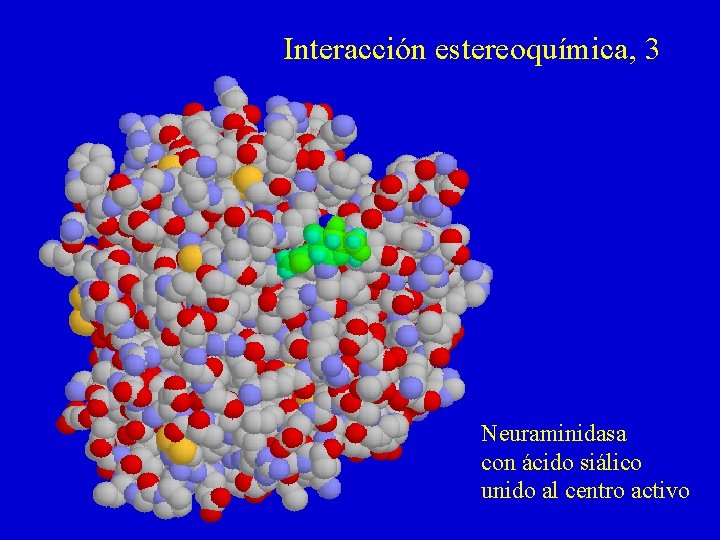
Interacción estereoquímica, 3 Neuraminidasa con ácido siálico unido al centro activo

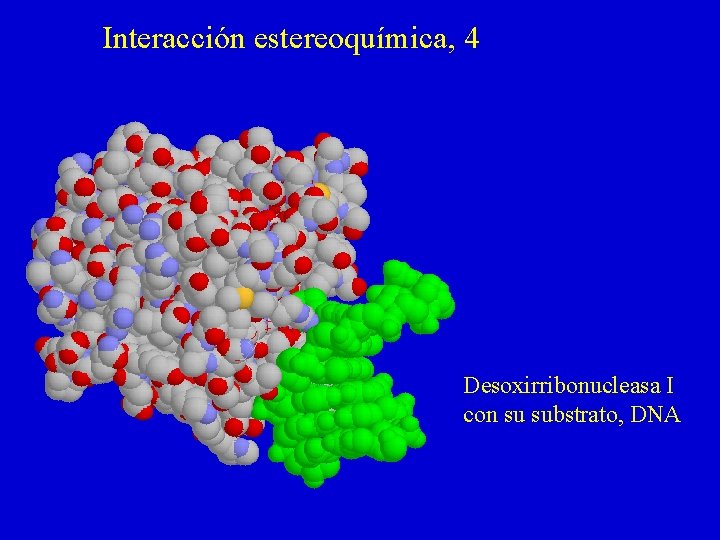
Interacción estereoquímica, 4 Desoxirribonucleasa I con su substrato, DNA



Clasificación de las proteínas I. Según solubilidad (obsoleta): Albúminas, Globulinas, Prolaminas, Gliadinas, Escleroproteínas, etc. II. Según presencia o no de un grupo prostético: Proteínas simples y Proteínas conjugadas Holoproteína = Apoproteína + Grupo prostético III. Según presencia o no de subunidades: Proteínas monoméricas y proteínas oligoméricas IV. Según estructura global: Proteínas fibrosas y proteínas globulares