11 Redoxreacties Even opfrissen Drie hoofdcategorien stoffen Moleculaire






























- Slides: 37

11 Redoxreacties

Even opfrissen: Drie hoofdcategorieën stoffen: ØMoleculaire stoffen: Atoombinding in molecuul (sterk), Van der Waals binding tussen moleculen (zwak), polaire (atoom)bindingen, daardoor H-bruggen tussen moleculen. ØMetalen: Metaalbinding (zeer sterk), dus hoog smeltpunt, geleiden ØZouten: Ionbinding (sterk), dus hoog smeltpunt, ionen

Inleiding in de Red. Ox chemie “Verbranding” van staalwol Reactievergelijking: 2 Fe(s) + O 2(g) 2 Fe. O(s) metaal moleculaire stof zout Er ontstaan ionen (geladen deeltjes)! Wat moet er dan gebeurd zijn? ? Ø IJzer heeft electronen afgestaan: Fe 2+ + 2 e. Het ijzeratoom is dus een ijzerion geworden! Ø Zuurstof heeft electronen opgenomen: O 2 + 4 e- 2 O 2 Het zuurstofmolecuul is gesplitst in twee zuurstofionen

Inleiding in de Red. Ox chemie Deeltjes die elektronen opnemen zijn oxidatoren Deeltjes die elektronen afstaan zijn reductoren We bekijken nog eens de vorige reactievergelijking: 2 x 2 e- 2 Fe(s) + O 2(g) 2 Fe. O(s) staat e- af: Reductor neemt e- op: Oxidator Als bij een reactie elektronenoverdracht plaatsvindt spreken we van een Red. Oxreactie!

Inleiding in de Red. Ox chemie Red. Ox of niet? Algemeen kun je stellen dat alle reacties waarbij de lading van een deeltje verandert, redoxreacties zijn. Verder zijn alle reacties waarbij elementen verdwijnen en/of ontstaan ook redoxreacties.

Inleiding in de Red. Ox chemie Halfreacties (Tabel 48 BINAS) Elke Red. Oxreactie is op te splitsen in twee halfreacties: Eén die het afstaan van elektronen weergeeft (reductor) Eén die het opnemen van elekronen weergeeft (oxidator) We bekijken weer ons voorbeeld: 2 Fe(s) + O 2(g) 2 Fe. O(s) Halfreactie (Red) Halfreactie (Ox) Totaal reactie Fe (s) O 2 (g) + 4 e- 2 Fe (s) + O 2 (g) Fe 2+ + 2 e 2 O 2 - 2 x 1 x + 2 Fe. O (s)

11. 3 Redoxkoppels • Onedele metalen zijn sterke reductoren • Een redox- koppel is een bij elkaar horend oxidator- reductorpaar: Li+(zwak) / Li (sterk) of F 2 /F(STERK) (zwak)

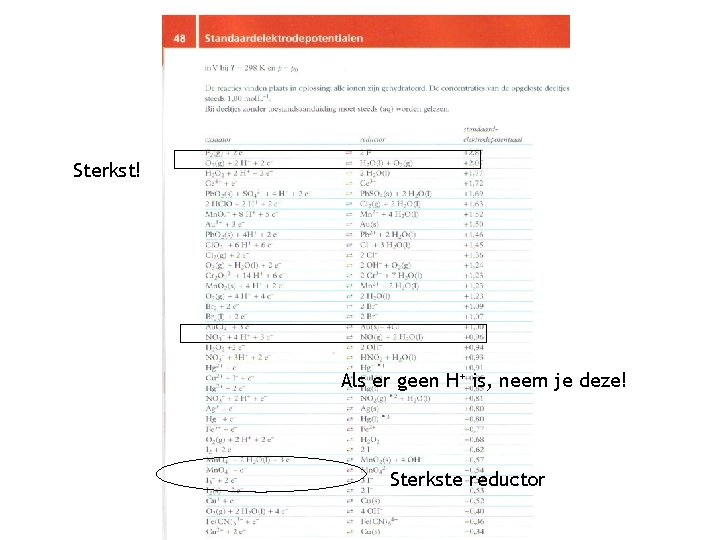
Standaardelektrodepotentiaal • V 0 zegt iets over de oxidatorsterkte: Hoe hoger V 0, hoe sterker de oxidator Een redoxreactie is aflopend: ∆V 0 ≥ 0, 3 V (∆V 0 = V 0(ox) – V 0 (red)) Er is sprake van een evenwichtsreactie: -0, 3 V‹ ∆V 0 ‹ 0, 3 V Er treedt geen reactie op als: ∆V 0 ≤ -0, 3 V

Opstellen van REDOX vergelijkingen 1. Schrijf de formules van alle deeltjes op. (Vergeet H 2 O niet!) 2. Ga met Binas 48 na of het een oxidator of reductor is. 3. Kies uit het rijtje de sterkste oxidator en de sterkste reductor. 4. Kijk of de reactie kan verlopen: OX moet boven RED staan. (∆V 0 ≤ -0, 3 V; dan geen reactie) 5. Schrijf de halfreacties op. De halfreactie van de reductor moet worden omgekeerd! 6. Tel de twee halfreacties op, zorg ervoor dat er evenveel elektronen worden opgenomen als afgestaan. De elektronen worden bij het optellen tegen elkaar weggestreept. 7. VEREENVOUDIGEN!

Let op! • 1. H+ hoort vaak bij een oxidator (of staat op zichzelf) • 2. Zowel OX als RED: H 2 O 2 H 2 O Fe 2+ en Sn 2+ • 3. SO 42 - is alleen OX als je geconcentreerd zwavelzuur hebt (-0. 09) • 4. NO 3 - is alleen OX in combinatie met H+. De combinatie NO 3 - + H+ komt twee keer voor: verdund salpeterzuur: ontstaat NO (bovenste: +0. 96) geconcentreerd salpeterzuur: NO 2 (onderste: +0. 80) Dus: SO 42 - en NO 3 - zonder H+ niet opnemen in de tabel!

Redoxvergelijkingen opstellen We dompelen een staafje chroom in een oplossing van nikkelchloride. 1. Schrijf de formules van alle deeltjes in het reactiemengsel op. (Vergeet H 2 O niet!) Oplossing van nikkelchloride, dus aanwezig: Ni 2+, Cl- en H 2 O Staafje chroom: Cr 2. Ga voor ieder deeltje na m. b. v. Binas 48 of het een oxidator of reductor is. ox: Ni 2+, H 2 O Deeltjes kunnen zowel ox als red zijn! red: Cl-, Cr, H 2 O 3. Kies m. b. v. Binas 48 de sterkste oxidator en de sterkste reductor. ox: red: Ni 2+ Cr

Inleiding in de Red. Ox chemie Redoxvergelijkingen opstellen 4. Kijk of de reactie kan verlopen: OX moet boven RED staan. Ni 2+ (-0, 26) staat links boven Cr (-0. 74); ∆V 0 ≥ 0, 3 V ; aflopend 5. Schrijf de halfreacties op. De halfreactie van de reductor moet worden omgekeerd! ox: Ni 2+ + 2 e Ni red: Cr 3+ + 3 e 6. Tel de twee halfreacties op, zorg ervoor dat er evenveel elektronen worden opgenomen als afgestaan. De elektronen worden bij het optellen tegen elkaar weggestreept. x 3 ox: Ni 2+ + 2 e Ni red: Cr 3+ + 3 e- 3 Ni 2+(aq) + 2 Cr(s) 3 Ni(s) + 2 Cr 3+(aq) x 2

REDOX en TABEL 48 Voorbeeld: waterstofperoxide (H 2 O 2) en een aangezuurde oplossing van kaliumjodide.

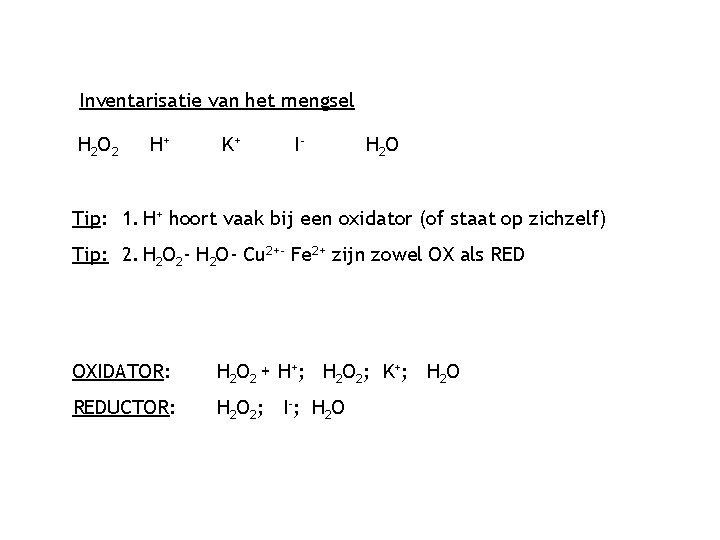
Inventarisatie van het mengsel H 2 O 2 H+ K+ I- H 2 O Tip: 1. H+ hoort vaak bij een oxidator (of staat op zichzelf) Tip: 2. H 2 O 2 - H 2 O- Cu 2+- Fe 2+ zijn zowel OX als RED OXIDATOR: H 2 O 2 + H+; H 2 O 2; K+; H 2 O REDUCTOR: H 2 O 2; I-; H 2 O

Sterkst! Als er geen H+ is, neem je deze! Sterkste reductor

Inleiding in de Red. Ox chemie Redoxvergelijkingen opstellen We schenken een waterstofperoxide-oplossing bij een aangezuurde natriumjodide-oplossing. 1. Schrijf de formules van alle deeltjes in het reactiemengsel op. (Vergeet H 2 O niet!) Oplossing van waterstofperoxide, dus aanwezig: H 2 O 2 en H 2 O Aangezuurde natriumjodide-oplossing: H+, Na+, I-, H 2 O 2. Ga voor ieder deeltje na m. b. v. Binas 48 of het een oxidator of reductor is. ox: H 2 O 2, H 2 O, Na+, H 2 O 2 + H+ Soms kom je een red: I- , H 2 O 2 , H 2 O combinatie van deeltjes tegen! 3. Kies m. b. v. Binas 48 de sterkste oxidator en de sterkste reductor. ox: red: H 2 O 2 + H + I-

Inleiding in de Red. Ox chemie Redoxvergelijkingen opstellen 4. Kijk of de reactie kan verlopen: OX moet boven RED staan. H 2 O 2 + H+ staat links boven I- ; de reactie kan verlopen 5. Schrijf de halfreacties op. De halfreactie van de reductor moet worden omgekeerd! ox: H 2 O 2 + 2 H+ + 2 e- 2 H 2 O red: 2 I I 2 + 2 e 6. Tel de twee halfreacties op, zorg ervoor dat er evenveel elektronen worden opgenomen als afgestaan. De elektronen worden bij het optellen tegen elkaar weggestreept. ox: H 2 O 2 + 2 H+ + 2 ered: 2 I- 2 H 2 O I 2 + 2 e- H 2 O 2(aq) + 2 H+(aq) + 2 I-(aq) 2 H 2 O(l) + I 2(s)

• Redoxreacties • Halfreacties

Zelf halfreacties opstellen • • • 1. 2. 3. 4. 5. Noteer de gegeven deeltjes. Maak de elementen kloppend, behalve O Maak de O atomen kloppend met H 2 O Maak de H atomen kloppend met H+ Maak de ladingen kloppend met e- • 6. Extra stap bij neutraal of basisch milieu: H+ wegwerken met OH • 7. Vereenvoudigen

Voorbeeld • Sulfide- ionen kunnen in basisch milieu worden omgezet tot sulfaat- ionen. – Stel de halfreactie op.

• • 1. 2. 3. 4. 5. 6. 7. Noteer de deeltjes Elementen O atomen met H 2 O H atomen met H+ Ladingen kloppend met e. Neutraal of basisch? Vereenvoudigen. • • • S 2 - SO 42 S klopt S 2 - + 4 H 2 O SO 42 - + 8 H+ + 8 e- • S 2 - + 4 H 2 O + 8 OH- SO 42 - + 8 H 2 O + 8 e- • S 2 - + 8 OH- SO 42 - + 4 H 2 O + 8 e-

Opdracht • Dichromaat- ionen worden omgezet in chroom- ionen in zuur- milieu • Dichromaat- ionen worden omgezet in chroom- ionen in neutraal milieu • Nogmaals de uitleg: Zelf opstellen van Redox

9. 3 Energie uit batterijen • Energiebron (zon, aarde, water en wind) • Energiedragers (brandstoffen, biomassa) Stoffen die door een reactie energie vrijgeven • Energievormen (zonne-, wind-, etc. )

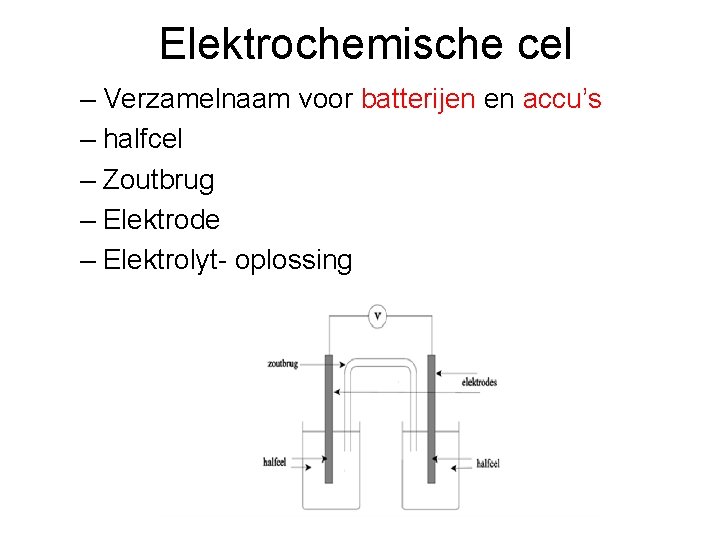
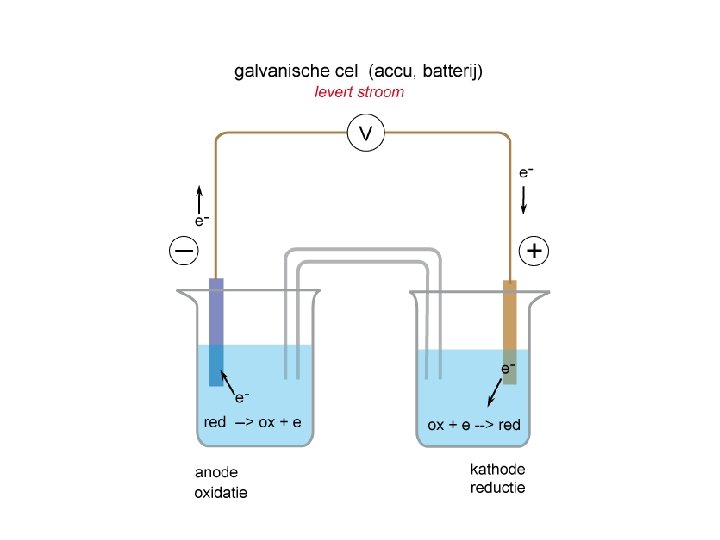
Elektrochemische cel – Verzamelnaam voor batterijen en accu’s – halfcel – Zoutbrug – Elektrode – Elektrolyt- oplossing

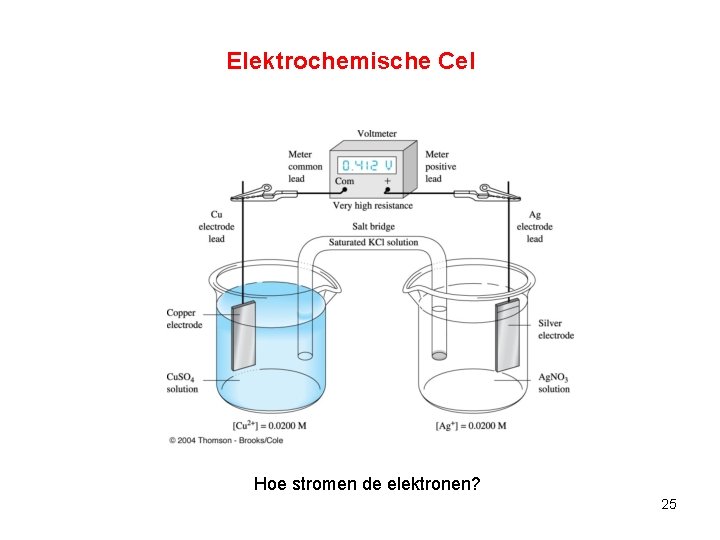
Elektrochemische Cel Hoe stromen de elektronen? 25

• De min- pool ontstaat aan de kant van de (sterkste) reductor • De plus- pool ontstaat aan de kant van de (sterkste) oxidator • Een Pt- elektrode en een C- elektrode doen nooit mee (inerte elektrode) als OX of RED


• Oplaadbare batterij Redox reactie omkeerbaar • Niet oplaadbare batterij Redox reactie niet omkeerbaar • Energiedichtheid Verhouding geleverde energie : massa batterij Eenheid: k. Wh (3. 6. 106 J)/ kg

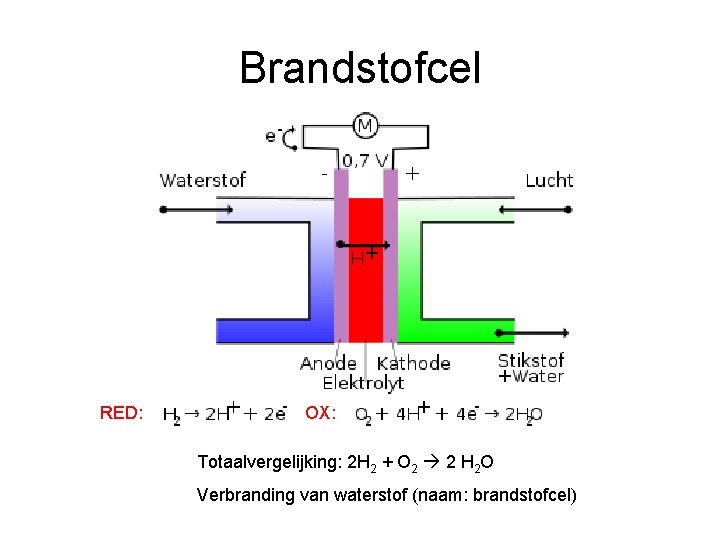
Brandstofcel RED: OX: Totaalvergelijking: 2 H 2 + O 2 2 H 2 O Verbranding van waterstof (naam: brandstofcel)

Brandstofcel • Open batterij. • In twee gescheiden ruimten stromen onafgebroken een brandstof (RED) en zuurstof (OX) naar binnen en reageren met elkaar. De reactieproducten stromen naar buiten. Chemische energie wordt zo omgezet in elektrische energie.

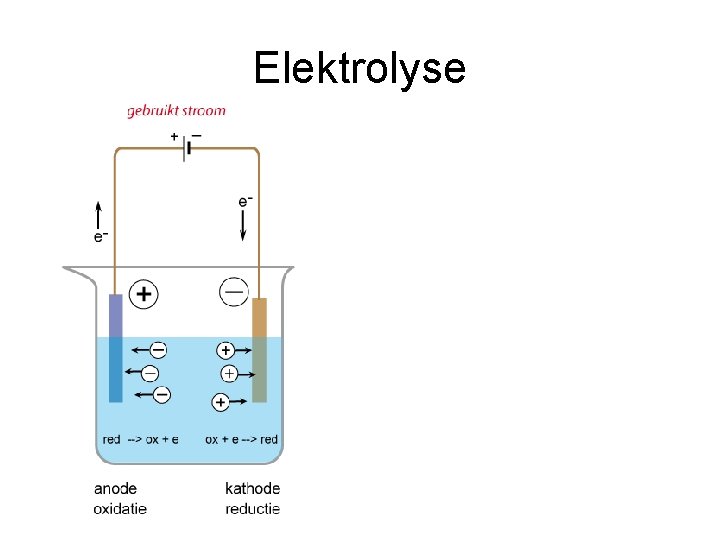
Elektrolyse • REDOX Reactie die altijd verloopt • Niet alleen ontledingsmethode • Reactie die verloopt onder invloed van een externe (gelijk)spanningsbron.

Elektrolyse

Let op! • De halfreacties mag je nooit optellen! • Bij de plus- pool reageert de sterkste reductor • Bij de min- pool reageert de sterkste oxidator • Als je moet kiezen tussen Cl- (+1. 36) en H 2 O (+1. 23) als RED dan wint Cl-!!!

Metalen • Alkalimetalen: deze staan in groep 1 van het PS • Aardalkalimetalen: deze staan in groep 2 van het PS • Eigenschappen Metalen hebben een aantal kenmerkende fysische eigenschappen: ze hebben meestal een glimmend uiterlijk ze zijn zwaar (hebben een hoge dichtheid) ze hebben meestal een hoog smeltpunt (met uitzondering van kwik (Hg) zijn alle metalen vaste stoffen bij kamertemperatuur) geleiden warmte en elektriciteit.

Legering • Mengsel van metalen (verbeteren eigenschappen) Brons (koper en tin) Messing (koper en zink)

Corrosie • Reactie met zuurstof (water) * Edel: reageren niet (Au-Pt- Ag * half- edel: bij hogere T wel met O 2 (Cu) Kamertemperatuur: * Onedel: niet met water wel met O 2 (Fe) * Zeer onedel: met zuurstof en met water (Na)

Beschermen tegen corrosie • 1. Aanbrengen van een beschermlaagje • 2. Mengen met een ander metaal (legering) • 3. Geleidend contact met een onedeler metaal (opofferingsmetaal)