1 OPAKOVANIE CHEMICK VZBA A TRUKTRA LTOK OPAKOVANIE

-1 - OPAKOVANIE CHEMICKÁ VÄZBA A ŠTRUKTÚRA LÁTOK OPAKOVANIE – CHEMICKÁ VÄZBA A ŠTRUKTÚRA LÁTOK -2 - Seminár z CH 12 (15. , 16. vyuč. hod. ) 14. V ktorej z molekúl etánu, etylénu, acetylénu je väzba medzi atómami uhlíka a) najdlhšia b) dvojitá c) najkratšia d) jednoduchá (PREHĽAD CHÉMIE – P. Silný, B. Brestenská str. 90 - 92) 1. Určte väzbovosť atómu: a) chlóru v molekule Cl 2 b) síry v molekule H 2 S c) uhlíka v molekule CO 2 d) fosforu v molekule PF 5 2. Ktoré orbitály sa prekrývajú pri vzniku väzby v molekule HBr ? 3. Z látok vyberte tie, v ktorých sú atómy prvkov viazané nepolárnou kovalentnou väzbou: HCl, Br 2 , CO 2 , Na. H, O 2 , H 2 , Ca. F 2. 4. Určte, v ktorých látkach: Li. F, Cl 2 , Na. Cl, KCl, Ba. F 2 , NH 3 , I 2 , H 2 O sú atómy prvkov viazané polárnou kovalentnou väzbou. 5. Napíšte, v ktorých látkach: Ti. C, H 2 O, HCl, BN, O 2 , KF, Si. O 2 , Ca. O sú atómy prvkov viazané iónovou väzbou. 6. Ktoré z týchto molekúl sú lineárne: HI, H 2 O, Cl 2 , Be. Cl 2 , CO, NH 3 , CO 2 ? 7. Bez použitia periodickej tabuľky určte v každej z nasledujúcich skupín látok najpolárnejšiu väzbu medzi atómami prvkov: a) H – Cl, H – F, H – I b) Na – Cl, Cs – Cl, K – Cl c) C – F , Si – F , Pb – F d) P – Cl, S – Cl e) S – Cl, S – F , S – Br 8. Predpovedajte, aké reálne iónové zlúčeniny môžu vzniknúť z uvedených dvojíc atómov. Napíšte ich vzorce. a) Rb a Cl b) Ca a O c) Ba a S d) Li a N 9. Určte, ktoré tvrdenie o väzbe v molekule Br 2 nie je správne: a) je nepolárne kovalentná b) vznikla prekryvom s orbitálov c) je pevnejšia ako väzba v molekule N 2 d) dipólový moment sa rovná nule 10. Ktoré z týchto molekúl majú lomený tvar: H 2 S, CO 2 , O 3 , HF, N 2 ? 11. Ktoré z týchto molekúl sú polárne: HCl, O 2 , Na. H, CHCl 3 , CCl 4 , CO 2 , H 2 O ? 12. Ktoré z týchto molekúl sú nepolárne: I 2 , HBr, CO, NH 3 , O 2 ? 13. Ktoré z týchto molekúl majú výsledný dipólový moment väčší ako nula: HI, Cl 2 , CHCl 3 , NH 3 , CCl 4 ? 15. Z atómov sodíka, vodíka, uhlíka, kyslíka a fluóru utvorte aspoň jednu dvojicu tak, aby medzi nimi vznikli väzby: a) nepolárna σ b)polárna σ c) nepolárna σ + π d) nepolárna σ + 2π e) iónová 16. Vodíková väzba sa vyskytuje v zlúčeninách vodíka: a) s uhlíkom b) s fluórom, c) s kyslíkom d) so sodíkom e) s dusíkom Vyberte správnu odpoveď. 17. Vysvetlite, prečo hydridy prvých prvkov VI. A a VII. A skupiny majú väčšie teploty varu v porovnaní s ostatnými hydridmi prvkov uvedených skupín. 18. Určte, ktorá zo zlúčenín C 2 H 5 OH alebo C 2 H 5 SH má vyššiu teplotu varu. Odpoveď zdôvodnite. 19. Zoraďte halogénvodíky podľa klesajúcej polarity väzby H – X. 20. Napíšte, ktorá z väzieb v látkach KCl, Na. Cl, F 2 , Fe. Cl 2 má najväčší stupeň iónového charakteru. Odpoveď zdôvodnite. 21. Zlúčeniny: Na. Cl, Na. Br, Na. I, Na. F zoraďte podľa klesajúceho iónového charakteru väzby. 22. Ktorá z týchto zlúčenín : HFO 4 , SF 6 , OF 2 , CF 4 , Cl. F neexistuje? 23. Určte medzi ktorými z uvedených molekúl vzniká vodíková väzba: H 2 , CH 4 , HF, H 2 O. 24. Porovnajte geometriu molekuly vody a amoniaku. 25. Vysvetlite, prečo existujú ióny [Al(H 2 O)6 ]3+ , [Al. F 6]3– , zatiaľ čo ióny [B(H 2 O)6]3+ a [BF 6 ]3– neexistujú. 26. Ktorá z uvedených látok PH 3 , Na, KCl, Ti. C, Ne, BN má iónovú štruktúru? 27. Ktoré z uvedených látok Si, KBr, Ca, H 2 S, I 2 , P 4 vytvárajú molekulové kryštály? 28. Ktoré z uvedených látok vytvárajú atómové kryštály: Al, Si, Na. F, N 2 , Ti. C, BN, Br 2 , NH 3 ? 29. Aké stavebné častice sú v kryštálových štruktúrach týchto látok? a) jód b) diamant c) ľad d) chlorid sodný e) hydrid sodný 30. Aké typy väzieb existujú v kryštáloch týchto látok? a) kremík b) chlorid cézny c) zinok d) bróm e) diamant

-3 - -4 - TYPY CHEMICKÝCH REAKCIÍ 7 CHEMICKÉ REAKCIE A CHEMICKÉ ROVNICE OPAKOVANIE pokračovanie (Chémia pre 1. roč. gymn. s. 97 -104; 31. Uvedené vlastnosti priraďte zodpovedajúcej modifikácii uhlíka (grafit – diamant): a) ľahká štiepateľnosť pozdĺž vrstiev b) elektrická a tepelná vodivosť c) vysoký index lomu d) mimoriadna tvrdosť e) v rôznych smeroch rôzne vlastnosti 32. Vysvetlite, prečo je pri bežných podmienkach oxid kremičitý tuhý a oxid uhličitý plynný. 33. Určte, ktorá z nasledujúcich teplôt topenia a) -109°C b) 801°C patrí chloridu sodnému a ktorá chloridu boritému. Zdôvodnite rozdiel teplôt topenia. 34. Porovnajte rozpustnosť I 2 a KI vo vode. Čím je spôsobený rozdiel v ich rozpustnosti ? 35. Určte, ktoré tvrdenia o vlastnostiach látok s iónovou kryštálovou štruktúrou sú správne: a) majú vysokú teplotu topenia b) dobre sa rozpúšťajú v polárnych rozpúšťadlách c) za bežných podmienok sa nachádzajú v plynnom skupenstve d) v tuhom skupenstve dobre vedú elektrický prúd 36. Ktorý z halogenidov KF, CCl 4 má väčšiu teplotu topenia, rozpúšťa sa vo vode a jeho roztok vedie elektrický prúd? Odpoveď zdôvodnite. 37. Prečo sa pri bežných podmienkach vyskytuje kyslík v plynnom skupenstve? 38. Teplota topenia oxidu vápenatého je 2 570°C, zatiaľ čo teplota topenia vody je pri teplote 0°C. Vysvetlite tento veľký rozdiel teplôt topenia daných látok. DIPÓLOVÝ MOMENT (PREHĽAD CHÉMIE – P. Silný, B. Brestenská str. 64 - 65) V zlúčeninách s kovalentnou nepolárnou väzbou je ťažisko kladného a záporného náboja v jednom bode. Polárne molekuly majú elektrický náboj rozložený nesymetricky, takže v jednej časti molekuly prevláda kladný náboj a v druhej záporný. Takéto molekuly tvoria dipóly. Príkladom je molekula HF. polaritu molekúl možno kvantitatívne charakterizovať dipólovým momentom δ+ δ– μ = Q. I , kde Q je náboj, I je vzdialenosť nábojov. Dipólový moment je vektorová veličina, udáva sa v jednotkách C. m. V literatúre sa častejšie uvádza jednotka D (Debye), pričom platí 1 D = 3, 33. 10– 30 C. m. Dipól v molekule HF Z hodnôt dipólových momentov možno získať rôzne dôležité informácie o molekulách, napríklad o stupni iónovosti kovalentnej väzby v molekule, alebo o štruktúre molekuly atď. Príklady: Z hodnoty dipólového momentu molekuly CO 2 μ = 0 D vyplýva, že molekula CO 2 je lineárna, pretože výsledný dipólový moment molekuly sa rovná vektorovému súčtu dipólových momentov jednotlivých väzieb. Tabuľka Dipólové momenty niektorých molekúl Molekula μ D Molekula μ 10– 30 C. m. HF 6, 36 1, 91 CO 2 0 HCl 3, 43 1, 03 CS 2 0 HBr 2, 63 0, 79 NH 3 4, 86 HI 1, 27 0, 38 PH 3 1, 83 NO 0, 43 0, 13 As. H 3 0, 50 H 2 O 6, 13 1, 84 SO 3 0 H 2 S 3, 10 0, 93 CH 4 0 HCN 9, 60 2, 88 CCl 4 0 SO 2 5, 36 1, 61 PCl 5 0 Seminár z CH 12 (15. , 16. vyuč. hod. ) D 0 0 1, 46 0, 55 0, 15 0 0 Molekula vody má μ ≠ 0 D, z čoho vyplýva, že táto molekula nie je lineárna. Ale má zalomený tvar. Molekula CCl 4 má μ = 0 D, lebo v symetrickom usporiadaní tetraedrickej štruktúry je súčet dipólových momentov jednotlivých väzieb rovný nule. 7. 1 Chemické reakcie pre 1. ročník gymnázií Už poznáte chemické reakcie ako premeny, pri ktorých z určitých chemických látok vznikajú iné chemické látky. Chemické reakcie majú pre človeka veľký význam. Prebiehajú napríklad pri fotosyntéze, pri ktorej vzniká kyslík nevyhnutný pre život, prebiehajú pri trávení potravín, ktoré sú zdrojom energie, pri príprave a výrobe rôznych látok, pri korózii kovov, hnití a kvasení rôznych látok. Chemické látky, ktoré reagujú, sa nazývajú reaktanty. Chemické látky, ktoré počas reakcie vznikajú, sa nazývajú produkty. Počas chemických reakcií nastávajú zmeny chemických väzieb medzi časticami chemických látok. Zanikajú pôvodné väzby v reaktantoch a vznikajú nové väzby v produktoch. Počet a druh atómov sa pri chemických reakciách nemení, čo potvrdzuje, že sa pri chemických reakciách hmotnosť reaktantov rovná hmotnosti produktov. Hovorí o tom zákon zachovania hmotnosti pri chemických reakciách. Oboznámili ste sa aj s dvoma typmi chemických reakcií, a to s chemickým zlučovaním a chemickým rozkladom. Toto delenie chemických reakcií však nie je úplné. Chemické reakcie látok možno triediť pomocou viacerých kritérií. Staršie triedenie vychádza z vonkajších, javových znakov reakcie, novšie rešpektujú väzbové zmeny pri reakciách, charakter reagujúcich alebo prenášaných častíc a pod. Za kritérium sa môže však považovať aj určitá charakteristika vystihujúca len niektorú čiastkovú stránku chemickej reakcie, ako napríklad energetické zmeny počas jej priebehu alebo či reakcia prebieha izolovane, alebo v sústave spolu s ďalšími rôznymi reakciami. V tomto školskom roku si budeme podrobnejšie charakterizovať chemické reakcie anorganických látok. Pre triedenie chemických reakcií anorganických látok považujeme za základné tieto kritériá: 1. Celková vonkajšia zmena pri chemickej reakcii: a) skladné (syntetické, syntézy) reakcie – jednoduchšie východiskové látky sa zlučujú a vznikajú zložitejšie látky: A+B → C 3 H 2 + N 2 → 2 NH 3 b) rozkladné (analytické) reakcie – zložitejšie látky sa štiepia na jednoduchšie látky: A → B+C Ca. CO 3 → Ca. O + CO 2 c) substitučné (vytesňovacie) reakcie – atóm alebo skupina atómov v molekule danej zlúčeniny je vymenená za iný atóm alebo skupinu atómov: AB + C → A + CB Cu. SO 4 + Fe → Cu + Fe. SO 4 d) podvojná zámena (konverzia) reakcie – dochádza k dvom substitúciám: AB + CD → AD + CB Ba. Cl 2 + K 2 SO 4 → Ba. SO 4 + 2 KCl 2. Mechanizmus priebehu chemickej reakcie: a) redoxné reakcie – dochádza k zmene oxidačných čísel atómov alebo iónov: Zn + 2 HCl → Zn. Cl 2 + H 2 b) protolytické reakcie – nastáva prijímanie a odovzdávanie protónov medzi kyselinou a zásadou: HCl + Na. OH → Na. Cl + H 2 O

-5 c) zrážacie reakcie – vznikajú málo rozpustné produkty (zrazeniny): Ag. NO 3 + Na. Cl → Ag. Cl + Na. NO 3 d) komplexotvorné reakcie – vznikajú komplexné (koordinačné) zlúčeniny: BF 3 + F– → [BF 4]– TYPY CHEMICKÝCH REAKCIÍ -6 - Seminár z CH 12 (15. , 16. vyuč. hod. ) Kvalitatívno-kvantitatívny význam chemických rovníc Chemické rovnice neudávajú len reaktanty a produkty reakcie, ale aj pomery hmotností, látkových množstiev, prípadne objemov látok, ktoré zreagovali alebo vznikli reakciou. Napríklad pri tepelnom rozklade tuhého uhličitanu vápenatého vzniká tuhý oxid vápenatý a plynný oxid uhličitý. Chemickú reakciu zapíšeme rovnicou: Ca. CO 3(s) → Ca. O (s) + CO 2 (g) Z rovnice napríklad vyplýva, že z 1 mólu Ca. CO 3 vznikne 1 mól Ca. O a 1 mól CO 2. Všeobecne platné poznatky o uvedených typoch chemických reakcií spolu s poznatkami z termochémie, chemickej kinetiky a rovnováhy umožnia nielen vysvetliť, ale aj predpovedať priebeh mnohých chemických reakcií anorganických látok. 7. 2 Schémy a rovnice chemických reakcií Chemické reakcie môžeme zapisovať chemickými schémami alebo chemickými rovnicami. Na ich ľavú stranu píšeme značky prvkov alebo vzorce zlúčenín reaktantov. Na pravú stranu píšeme značky prvkov alebo vzorce zlúčenín produktov. Schémy chemických reakcií V schémach chemických reakcií sú strany reaktantov a produktov spojené prerušovanou šípkou. Napríklad: H 2 + O 2 – –► H 2 O Zo schémy reakcie vidíme, že počet atómov jednotlivých prvkov reaktantov sa nerovná počtu atómov prvkov v produktoch. Reakčné schémy často obsahujú len hlavné reaktanty a hlavné produkty. Rovnice chemických reakcií V chemických rovniciach sú obidve strany spojené plnou šípkou smerujúcou od reaktantov k produktom. Celkový počet atómov jednotlivých prvkov reaktantov musí byť rovnaký ako celkový počet atómov prvkov v produktoch. V súlade so zákonom zachovania hmotnosti sa hmotnosť reaktantov rovná hmotnosti produktov. Preto pre vyššie uvedenú chemickú reakciu vodíka s kyslíkom je chemickou rovnicou: 2 H 2 + O 2 → 2 H 2 O Číslo pred značkou prvku alebo vzorcom zlúčeniny nazývame stechiometrický koeficient. Chemickú rovnicu uvedenej reakcie vodíka s kyslíkom za vzniku vody čítame napríklad takto: Reakciou dvoch mólov vodíka s jedným mólom kyslíka vznikajú dva móly vody. Na základe molárnych ( starší názov mólových) hmotností reaktantov a produktov vieme, že zo 100, 09 g Ca. CO 3 vznikne 56, 08 g Ca. O a 44, 01 g CO 2. Reakciou vznikne 1 mól plynného CO 2 , ktorý zaberá pri normálnych podmienkach objem 22, 41 dm 3 (normálne podmienky 0°C, 101, 325 k. Pa). Na základe chemických rovníc môžeme vypočítať látkové množstvo, hmotnosť a objem reaktantov a produktov. 7. 2. 1 Rôzne spôsoby zápisu rovníc chemických reakcií Chemické reakcie môžeme zapísať rôznymi chemickými rovnicami. Budeme používať tieto spôsoby: 1. stechiometrický, 2. stavový, 3. úplný iónový, 4. skrátený iónový. Ako zapisujeme chemické reakcie uvedenými spôsobmi zápisu, ukážeme na chemickej reakcii roztoku hydroxidu sodného s roztokom kyseliny chlorovodíkovej, ktorých produktom je roztok chloridu sodného a voda. 1. Stechiometrický zápis V tomto zápise chemických reakcií sa používajú vzorce reaktantov a produktov. Napríklad zvolenú chemickú reakciu zapíšeme: Na. OH + HCl → Na. Cl + H 2 O 2. Stavový zápis V tomto zápise symbolmi, ktoré vyjadrujú skupenstvo látok – s (tuhé), l (kvapalné), g (plynné), vyznačíme skupenský stav jednotlivých reaktantov a produktov. Symbolom aq označíme látku, ktorá sa nachádza vo vodnom roztoku. Neutralizáciu zapíšeme stavovým zápisom: Na. OH (aq) + HCl (aq ) Na. Cl (aq) + H 2 O ( l ) Cvičenie 1 Jednotlivé schémy chemických reakcií upravte na chemické rovnice: a) Fe + S – –► Fe. S b) Na + Cl 2 – –►Na. Cl Riešenie 1 a) Fe + S → Fe. S b) 2 Na + Cl 2 → 2 Na. Cl Na základe stechiometrických koeficientov môžeme určiť pomery látkových množstiev reaktantov a produktov. Nazývame ich stechiometrické pomery. Napríklad z rovnice chemickej reakcie: 2 Na (s) + 2 H 2 O ( l ) 2 Na. OH (aq) + H 2(g) vyplýva, že sodík reaguje s vodou v pomere látkových množstiev 1 : 1, pomer látkového množstva sodíka k látkovému množstvu vzniknutého vodíka je 2 : 1. 3. Úplný iónový zápis V tomto zápise uvádzame vzorce všetkých iónov, ktoré sa nachádzajú v reakčnej sústave, spolu so vzorcami ostatných látok. Uvažovanú neutralizáciu zapíšeme úplným iónovým zápisom: Na+ + OH– + H+ + Cl– → Na+ + Cl– + H 2 O Použitím symbolov označujúcich stav látok zapíšeme reakciu takto: Na+(aq) + OH–(aq) + H+(aq) + Cl–(aq) → Na+(aq) + Cl–(aq) + H 2 O(l) 4. Skrátený iónový zápis V tomto zápise sa uvádzajú vzorce len tých iónov, ktoré spolu reagujú. Vzorce iónov, ktoré sa nachádzajú na ľavej aj pravej strane rovníc zapísaných úplným iónovým zápisom, sa neuvádzajú. Skrátený iónový zápis uvedenej neutralizácie: H+ + OH– → H 2 O Ak uvedieme aj stav reaktantov a produktov, zápis je: H+(aq) + OH–(aq) → H 2 O(l)

-7 - TYPY CHEMICKÝCH REAKCIÍ -8 - Seminár z CH 12 (15. , 16. vyuč. hod. ) 7. 4 Otázky a úlohy str. 103 -104 7. 3 Výpočty na základe chemických rovníc Pri príprave a výrobe chemických látok je potrebné vedieť množstvo reaktantov, ktoré potrebujeme na získanie určitého množstva produktov. Pri výpočte určitého množstva reaktantov a produktov na základe chemickej rovnice možno použiť niekoľko postupov. Oboznámime sa s dvoma: – prvý postup požíva trojčlenku, – druhý postup používa vzťah medzi veličinami. Pri výpočtoch z chemických rovníc vychádzame zo známeho poznatku, že podiel látkových množstiev látok sa rovná podielu ich stechiometrických koeficientov. Pre reakciu zapísanú všeobecnou rovnicou: a. A + b. B → c. C + d. D kde A a B sú reaktanty, C, D produkty; a, b, c, d sú príslušné stechiometrické koeficienty, platí: 1. Vypočítajte hmotnosť oxidu horečnatého, ktorý vznikne zhorením 48, 6 g horčíka v nadbytku kyslíka: 2 Mg + O 2 2 Mg. O M(Mg ) = 24, 3 g. mol-1 ; M(Mg. O ) = 40, 3 g. mol-1 [80, 6 g] 2. Síra reaguje s kyslíkom za vzniku oxidu siričitého: S + O 2 SO 2 Vypočítajte, aká hmotnosť síry je potrebná na prípravu 32, 05 g SO 2. M(S ) = 32, 10 g. mol-1 ; M(SO 2 ) = 64, 10 g. mol-1 [16, 05 g] 3. Vypočítajte, aká hmotnosť sodíka a vody je potrebná na prípravu 0, 5 g vodíka: 2 Na + 2 H 2 O 2 Na. OH + H 2 n(A), n(B) označujú látkové množstvá zreagovaných látok, n ( C), n( D) látkové množstvá vzniknutých produktov. Ďalej pri výpočtoch využívame napríklad vzťah medzi látkovým množstvom n, hmotnosťou m a molárnou hmotnosťou M. 7. 3. 1 Výpočet látkového množstva 2 H 2 + O 2 → 2 H 2 O Vodík reaguje s kyslíkom za vzniku vody. Reakciu zapíšeme rovnicou: Vypočítajte látkové množstvo kyslíka, ktoré zreaguje s 8 mólmi vodíka a látkové množstvo vzniknutej vody. Riešenie 2 S 8 mólmi vodíka zreagujú 4 móly kyslíka. [11, 5 g; 9 g] 4. Vypočítajte hmotnosť hydroxidu vápenatého, ktorý vznikne, ak zreaguje 4, 5 g vody s oxidom vápenatým: Ca. O + H 2 O Ca(OH)2 M(Ca. O ) = 56 g. mol-1 ; M [ Ca(OH)2 ] = 74 g. mol-1, M(H 2 O) = 18 g. mol-1 Cvičenie 2 a) Výpočet látkového množstva kyslíka Z rovnice chemickej reakcie vyplýva, že 2 móly H 2 zreagujú s 1 mólom O 2. Zo zadania vieme: n(H 2) = 8 mol 2 mol H 2. . 1 mol O 2 8 mol H 2. . x mol O 2 M(Na ) = 23 g. mol-1 ; M(H 2 O ) = 18 g. mol-1 , M(H 2) = 2, 0 g. mol-1 b) Výpočet látkového množstva vody 2 H 2 + O 2 2 H 2 O Z rovnice chemickej reakcie vyplýva, že ak zreagujú 2 móly H 2 , vzniknú 2 móly H 2 O. Zo zadania vieme: n(H 2) = 8 mol 2 mol H 2. . 2 mol H 2 O 8 mol H 2. . x mol O 2 Reakciou 8 mólov vodíka s kyslíkom vznikne 8 mólov vody. 7. 3. 2 Výpočet hmotnosti látok [18, 53 g] 5. Málo rozpustný biely chlorid strieborný možno pripraviť reakciou roztoku dusičnanu strieborného s roztokom chloridu sodného: Ag. NO 3 + Na. Cl Ag. Cl + Na. NO 3 ; Vypočítajte, aká hmotnosť Ag. NO 3 je potrebná na prípravu 10, 0 g Ag. Cl. M(Ag. NO 3 ) = 170 g. mol-1 , M(Ag. Cl) = 143 g. mol-1 [11, 9 g] 6. Vypočítajte hmotnosť striebra, ktorá sa získa tepelným rozkladom 1, 0 kg oxidu strieborného: 2 Ag 2 O 4 Ag + O 2 M(Ag 2 O ) = 232 g. mol-1 , M(Ag) = 108 g. mol-1 [ 0, 93 kg ] 7. Zhorením 0, 10 mólu horčíkovej pásky v plameni kahana vznikol biely prášok, oxid horečnatý. Vypočítajte jeho hmotnosť. 2 Mg + O 2 2 Mg. O M(Mg ) = 24 g. mol-1 ; M(Mg. O ) = 40, 3 g. mol-1 [ 4, 0 g] Cvičenie 3 Vypočítajte hmotnosť zinku, ktorá je potrebná na reakciu s kyselinou chlorovodíkovou, aby vzniklo 25 g chloridu zinočnatého Zn. Cl 2. Zn + 2 HCl Zn. Cl 2 + H 2 Riešenie 3 Prvý postup V chemických tabuľkách zistíme molárne hmotnosti zinku a chloridu zinočnatého. M(Zn) = 65, 39 g. mol-1 , M(Zn. Cl 2) = 136, 29 g. mol-1. Z rovnice chemickej reakcie vyplýva: Reakciou 1 mólu zinku (65, 39 g) s kyselinou chlorovodíkovou vznikne 1 mól chloridu zinočnatého (136, 29 g). Zo zadania vieme: m(Zn. Cl 2) = 25 g 65, 39 g Zn. . . . 136, 29 g Zn. Cl 2 x g Zn. . . . 25 g Zn. Cl 2 Na prípravu 25 g chloridu zinočnatého je potrebných 12 g zinku. Druhý postup - učebnica Chémie pre 1. roč. str. 102 8. Vypočítajte, koľko gramov oxidu ortutnatého sa musí rozložiť, aby vzniklo 3, 2 g kyslíka: 2 Hg. O 2 Hg + O 2 M(Hg. O ) = 217 g. mol-1 , M(O 2) = 32 g. mol-1 [ 43, 4 g ] *9. Tepelným rozkladom uhličitanu vápenatého vzniká oxid vápenatý a oxid uhličitý: Ca. CO 3 (s) Ca. O (s) + CO 2 (g) Vypočítajte: Vm = 22, 4 dm 3. mol-1 a) aká hmotnosť Ca. O, b) aké látkové množstvo CO 2, c) aký objem CO 2 pri normálnych podmienkach vznikne z 25 g Ca. CO 3. M(Ca. CO 3 ) = 100 g. mol-1 ; M(Ca. O ) = 56 g. mol-1 , M(CO 2) = 44 g. mol-1 [14 g; 0, 25 mol ; 5, 6 dm 3 ]
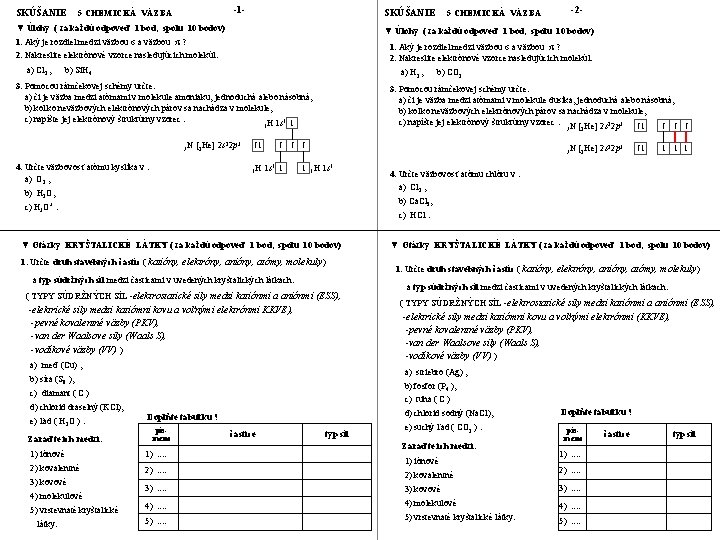
SKÚŠANIE -1 - 5 CHEMICKÁ VÄZBA SKÚŠANIE ▼ Úlohy ( za každú odpoveď 1 bod, spolu 10 bodov) 1. Aký je rozdiel medzi väzbou σ a väzbou π ? 2. Nakreslite elektrónové vzorce nasledujúcich molekúl: b) Si. H 4 a) H 2 , 3. Pomocou rámčekovej schémy určte: a) či je väzba medzi atómami v molekule amoniaku, jednoduchá alebo násobná, b) koľko neväzbových elektrónových párov sa nachádza v molekule, c) napíšte jej elektrónový štruktúrny vzorec. H 1 s 1 ↓ 4. Určte väzbovosť atómu kyslíka v : a) O 2 , 2 s 22 p 3 ↑↓ ↑ 1 H 1 s 1 ↓ ↑ ↑ 7 N [2 He] ↓ 1 H 1 s 1 b) H 2 O, 1. Určte druh stavebných častíc ( katióny, elektróny, anióny, atómy, molekuly ) a typ súdržných síl medzi časticami v uvedených kryštalických látkach. ( TYPY SÚDRŽNÝCH SÍL -elektrostatické sily medzi katiónmi a aniónmi (ESS), -elektrické sily medzi katiómni kovu a voľnými elektrónmi KKVE), -pevné kovalentné väzby (PKV), -van der Waalsove sily (Waals S), -vodíkové väzby (VV) ) ▼ Otázky KRYŠTALICKÉ LÁTKY ( za každú odpoveď 1 bod, spolu 10 bodov) 1. Určte druh stavebných častíc ( katióny, elektróny, anióny, atómy, molekuly ) a typ súdržných síl medzi časticami v uvedených kryštalických látkach. ( TYPY SÚDRŽNÝCH SÍL -elektrostatické sily medzi katiónmi a aniónmi (ESS), c) tuha ( C ) d) chlorid draselný (KCl), d) chlorid sodný (Na. Cl), Doplňte tabuľku ! písmeno 1) iónové 1). . 2) kovalentné 2). . látky. 4. Určte väzbovosť atómu chlóru v : a) Cl 2 , b) fosfor (P 4 ), c) diamant ( C ) 5) vrstevnaté kryštalické ↓ ↓ a) striebro (Ag) , b) síra (S 8 ), 4) molekulové ↓ -elektrické sily medzi katiómni kovu a voľnými elektrónmi (KKVE), -pevné kovalentné väzby (PKV), -van der Waalsove sily (Waals S), -vodíkové väzby (VV) ) a) meď (Cu) , 3) kovové ↑↓ c) HCl. ▼ Otázky KRYŠTALICKÉ LÁTKY ( za každú odpoveď 1 bod, spolu 10 bodov) Zaraďte ich medzi: 2 s 22 p 3 b) Ca. Cl 2, c) H 3 O+. e) ľad ( H 2 O ). b) CO 2 3. Pomocou rámčekovej schémy určte: a) či je väzba medzi atómami v molekule dusíka, jednoduchá alebo násobná, b) koľko neväzbových elektrónových párov sa nachádza v molekule, c) napíšte jej elektrónový štruktúrny vzorec. N [ He] 2 s 22 p 3 ↑↓ ↑ ↑ ↑ 7 2 1 7 N [2 He] -2 - ▼ Úlohy ( za každú odpoveď 1 bod, spolu 10 bodov) 1. Aký je rozdiel medzi väzbou σ a väzbou π ? 2. Nakreslite elektrónové vzorce nasledujúcich molekúl: a) Cl 2 , 5 CHEMICKÁ VÄZBA častice typ síl e) suchý ľad ( CO 2 ). Zaraďte ich medzi: 1) iónové 2) kovalentné Doplňte tabuľku ! písmeno 1). . 2). . . . 3) kovové 3). . . . 4) molekulové 4). . . . 5) vrstevnaté kryštalické látky. 5). . častice typ síl
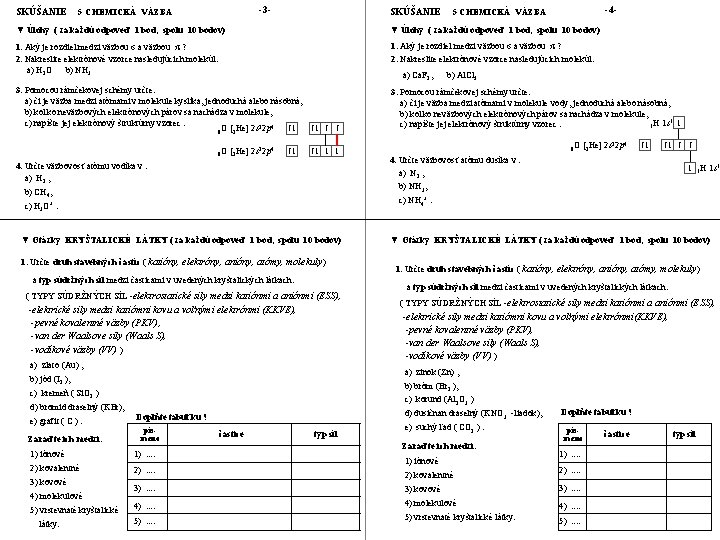
SKÚŠANIE -3 - 5 CHEMICKÁ VÄZBA SKÚŠANIE -4 - 5 CHEMICKÁ VÄZBA ▼ Úlohy ( za každú odpoveď 1 bod, spolu 10 bodov) 1. Aký je rozdiel medzi väzbou σ a väzbou π ? 2. Nakreslite elektrónové vzorce nasledujúcich molekúl: a) H 2 O b) NH 3 1. Aký je rozdiel medzi väzbou σ a väzbou π ? 2. Nakreslite elektrónové vzorce nasledujúcich molekúl: 3. Pomocou rámčekovej schémy určte: a) či je väzba medzi atómami v molekule kyslíka, jednoduchá alebo násobná, b) koľko neväzbových elektrónových párov sa nachádza v molekule, c) napíšte jej elektrónový štruktúrny vzorec. 2 4 ↑↓ ↑↓ ↑ ↑ 8 O [2 He] 2 s 2 p 3. Pomocou rámčekovej schémy určte: a) či je väzba medzi atómami v molekule vody, jednoduchá alebo násobná, b) koľko neväzbových elektrónových párov sa nachádza v molekule, 1 ↓ c) napíšte jej elektrónový štruktúrny vzorec. 1 H 1 s a) Ca. F 2 , 8 O [2 He] 2 s 22 p 4 ↑↓ 1. Určte druh stavebných častíc ( katióny, elektróny, anióny, atómy, molekuly ) a typ súdržných síl medzi časticami v uvedených kryštalických látkach. ( TYPY SÚDRŽNÝCH SÍL -elektrostatické sily medzi katiónmi a aniónmi (ESS), -elektrické sily medzi katiómni kovu a voľnými elektrónmi (KKVE), -pevné kovalentné väzby (PKV) , -van der Waalsove sily (Waals S), -vodíkové väzby (VV) ) ▼ Otázky KRYŠTALICKÉ LÁTKY ( za každú odpoveď 1 bod, spolu 10 bodov) 1. Určte druh stavebných častíc ( katióny, elektróny, anióny, atómy, molekuly ) a typ súdržných síl medzi časticami v uvedených kryštalických látkach. ( TYPY SÚDRŽNÝCH SÍL -elektrostatické sily medzi katiónmi a aniónmi (ESS), a) zinok (Zn) , b) jód (I 2 ), b) bróm (Br 2 ), c) kremeň ( Si. O 2 ) c) korund (Al 2 O 3 ) d) bromid draselný (KBr), d) dusičnan draselný (KNO 3 -liadok), Doplňte tabuľku ! písmeno 1) iónové 1). . 2) kovalentné 2). . látky. ↓ 1 H 1 s 1 -elektrické sily medzi katiómni kovu a voľnými elektrónmi(KKVE), -pevné kovalentné väzby (PKV), -van der Waalsove sily (Waals S), -vodíkové väzby (VV) ) a) zlato (Au) , 5) vrstevnaté kryštalické ↑↓ ↑ ↑ c) NH 4+. ▼ Otázky KRYŠTALICKÉ LÁTKY ( za každú odpoveď 1 bod, spolu 10 bodov) 4) molekulové ↑↓ b) NH 3, c) H 3 O+. 3) kovové 2 s 22 p 4 4. Určte väzbovosť atómu dusíka v : a) N 2 , b) CH 4, Zaraďte ich medzi: 8 O [2 He] ↑↓ ↓ ↓ 4. Určte väzbovosť atómu vodíka v : a) H 2 , e) grafit ( C ). b) Al. Cl 3 častice typ síl e) suchý ľad ( CO 2 ). Zaraďte ich medzi: 1) iónové 2) kovalentné Doplňte tabuľku ! písmeno 1). . 2). . . . 3) kovové 3). . . . 4) molekulové 4). . . . 5) vrstevnaté kryštalické látky. 5). . častice typ síl
- Slides: 6