1 Introduction 2 Tsunami http www flickr com













































































































![วธทำ ci = = = [(p MMi) /RT] * i (1. 0135*105 Nm-2) (48 วธทำ ci = = = [(p MMi) /RT] * i (1. 0135*105 Nm-2) (48](https://slidetodoc.com/presentation_image_h/a96abe042302faf31f41610fd29af27f/image-124.jpg)
















- Slides: 140


บทท 1 บทนำ (Introduction) 2


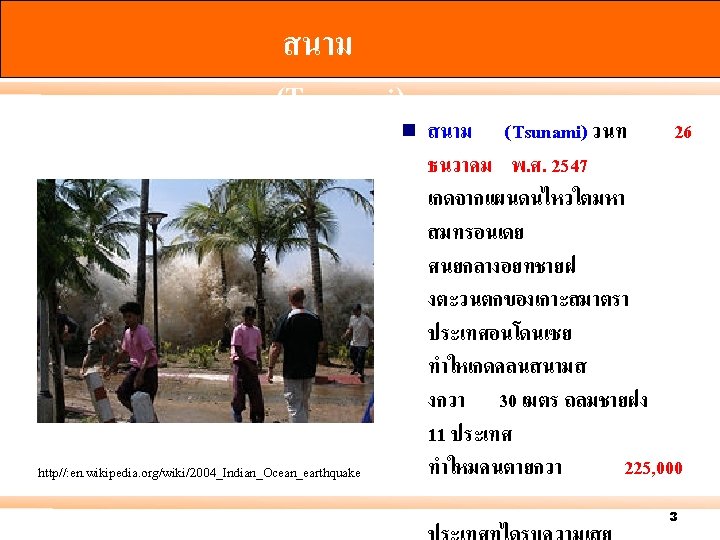
สนาม (Tsunami) ภเกต http//: www. flickr. com 4

Cyclone Nagis ถลมลมนำอระวด ประเทศพมา วนท 2 พฤษภาคม พ. ศ. 2551 สงผลใหมคนตายกวา 90, 000 คน สญหายกวา 56, 000 คน (http//: en. wikipedia. org/wiki/Cyclone_Nargis) http//: www. marketatnation. com/newsletter/news/gallery 01/index-news-burma. html 5

Cyclone Nagis http//: www. marketatnation. com/newsletter/news/gallery 01/index-news-burma. html 6



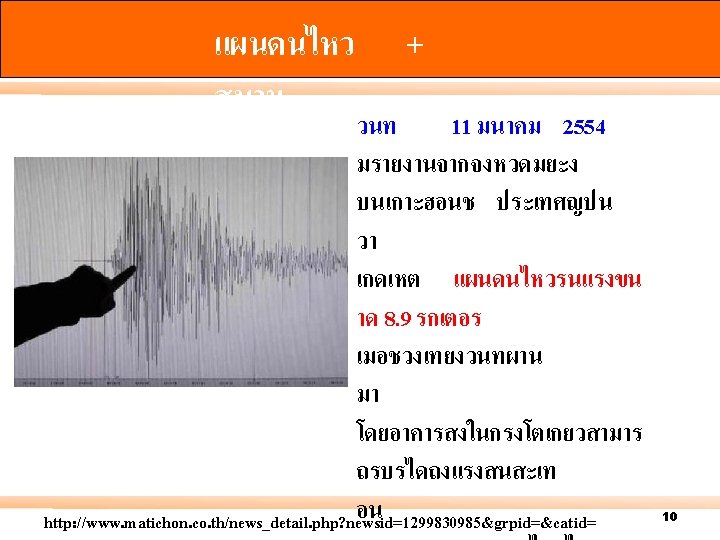
แผนดน ไหว http//: en. wikipedia. org/wiki/2008_Sichuan_earthquake 9










องคกรทกำหนดมาตรฐานดานมลพษทางอากาศ Organisations determined standard methods for air sampling n ASTM = the American Society for Testing and Materials n EPA = the Environmental Protection Agency n NAAQS = the National Ambient Air Quality Standards n UNEP = the United Nations Environment Programme n WHO = the World Health Organization 19

องคกรทกำหนดมาตรฐานดานมลพษทางอากาศ n ACGIH = the American Conference of n COSH = n HSE = n NIOSH = n OSHA = Governmental Industrial Hygienists Control of Substances Hazardous to Health Regulation the Health and Safety Executive the National Institute of Occupational Safety and Health the Occupational Safety and Health Administration 20
















36




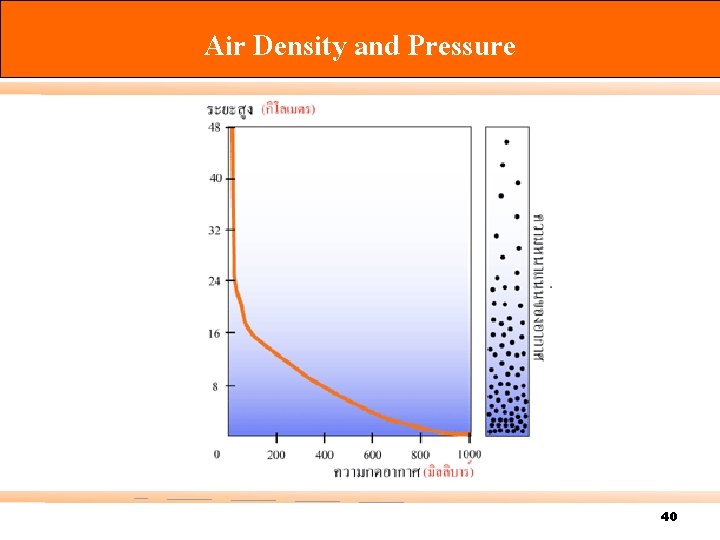
Air Density and Pressure 40





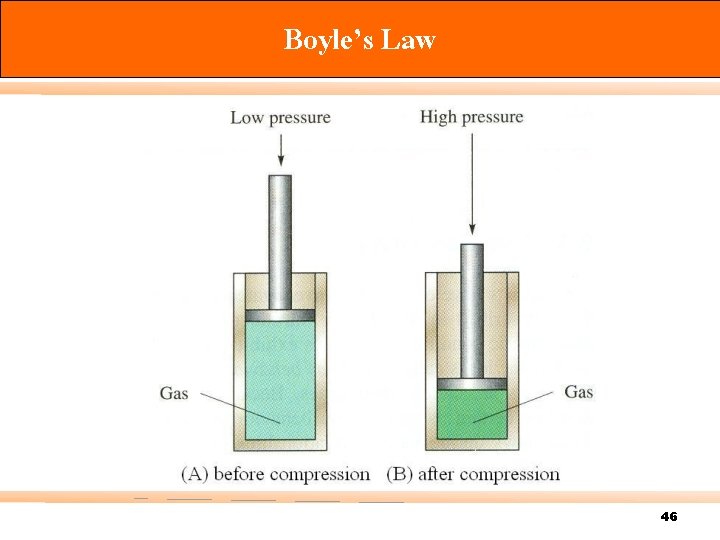
Boyle’s Law At n, T = constants; V V = PV = where; V = volume P = pressure k. B = a proportionality constant P 1 V 1 = 1 / P k. B / P k. B P 2 V 2 45

Boyle’s Law 46

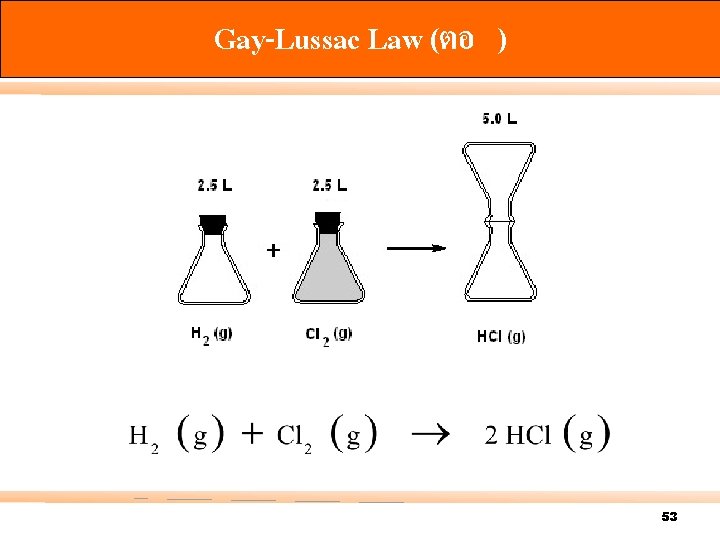
. 2 Charles’s Law and Gay-Lussac’s Law Jacques Charles นกฟสกสชาวฝรงเศส คนพบ ผลของอณหภมตอปรมาตรของกาซ ค. ศ. 1787 และ Joseph Louis Guy-Lussac นกเคมชาวฝรงเศสในป ค. ศ. 1802 ในป “The volume occupied by a gas changes in direct proportion to its absolute temperature ) T= t+ 273. 15) at constant pressure” 47


Charles’s Law At n, P = constant; V V/T = V 1 = T 1 T k. C V 2 T 2 49

Charles’s Law 50



Gay-Lussac Law (ตอ ) 53

. 3 Avogadro’s Laws Amadeo Avogadro นกฟสกสชาวอตาเลยน ไดนำ Gay-Lussac’s Law ไปใชในการอธบายความสมพนธระหวางปรม าตรและจำนวนโมลของกาซโดยใชทฤษฎอะตอม (Atomic Theory) ในป ค. ศ. 1811 “The volume occupied by a gas at a given temperature and pressure is proportional to the number of gas molecules and thus to the moles of a gas (n”( 54

Avogadro’s Laws At P, T = constant; V n V = k. A n V 1 n 1 = V 2 n 2 55


. 4กฎรวมของกาซ (Combined Gas Law) เปนการรวมความสมพนธของ Boyle's Law และ Charles’s Law เขาดวยกน “A constant amount of gas, the volume is proportional to the absolute temperature divided by the pressure” 57






n ความหนาแนนของกาซ n = PV = V = = d = = (Gas density) m/ MM (m/MM)RT [(m/MM)RT]/P (m/MM)(RT/P) m/V m/ [(m/MM)(RT/P)] P* MM/ RT 63

n Molar mass of a gas n = m/MM PV = (m/MM) RT MM = m. RT/ PV 64


วธทำ moles CO 2: n moles Ca. CO 3: n g Ca. CO 3 : m Ca. O(s) + CO 2(g) Ca. CO 3(s) = PV/RT = 1. 37 atm * 3. 45 L 0. 08206 L atm/ mol K * (45 + 273. 15)K = 0. 181 mol = 0. 181 mol CO 2 * 1 mol Ca. CO 3 1 mol CO 2 = 0. 181 mol Ca. CO 3* 100. 1 g Ca. CO 3 1 mol Ca. CO 3 = 18. 1 g 66



วธทำ C = = = (P * MM) / (RT) 1 atm * 48 g mol-1 (0. 08206 L atm mol-1 K-1) (298 K) 1. 963 g/ L x 103 mg/g x 103 L/m 3 1. 963 * 106 mg m-3 ความเขมขนของโอโซน = 1. 963 * 106 mg m-3 69



วธทำ PV C C = n. RT = n/V = P/ (RT) = 1. 01325*105 N m-2 (8. 314 Nm mol-1 K-1) (298 K) 40. 897= mol m-3 40. 897 mol m) =-3) (m 3 / 106 cm 3) (6. 022*1023 molecules mol-1( 1910*2. 463= molecules cm-3 Avogadro’s number (NA) = 6. 022 * 1023 molecules / mole 72





77


Measure the rate of effusion of a gas 79

Measure the rate of effusion of a gas 80

Measure the relative rates of diffusion of two gases 81

Rates of Effusion and Diffusion Graham’s Law states that “the rate of effusion of gas is inversely proportional to the square root of the gas’s molar mass” The rate of effusion (r) of two gases at the same temperature and pressure are related as follows: r 1/ r 2 = MM 2/ MM 1 r 1/ r 2 = d 2/ d 1 82





Kinetic-Molecular Theory of Gases )ตอ ( n พลงงานจลนเฉลยเนองจากการเคลอนทของโมเลก ลของกาซจะแปรผนตรงกบอณหภมสมบรณ temperature): (absolute KEav = 3/2 k. T เมอ k = Boltzmann constant = 1. 3806 x 10 -19 cm 3 mb K-1 k = R/ N เมอ R = the universal gas constant = 0. 083145 m 3 mb mole-1 K-1 N = Avogadro’s number = 6. 02252 x 1023 molecules / mole 87

Kinetic-Molecular Theory of Gases )ตอ ( n พลงงานจลน สามารถแสดงในรปมวลของกาซ (m) และความเรว ( ) KE = ½ m 2 KEav = ½ m av 2 KE 1, av = KE 2, av ½ m 1( 1, av)2 = ½ m 2( 2, av)2 m 1 / m 2 = ( 2, av / 1, av)2 2, av / 1, av = (m 1 / m 2)1/2 This equation is the same form as Graham’s law. 88

Distribution of velocities of gaseous particles 89



ทำไมโมเลกลของกาซจงดงดดระหวางกนได ? London dispersion forces: the attractive forces that arise from polarization of adjacent non polar molecules or atoms. 92

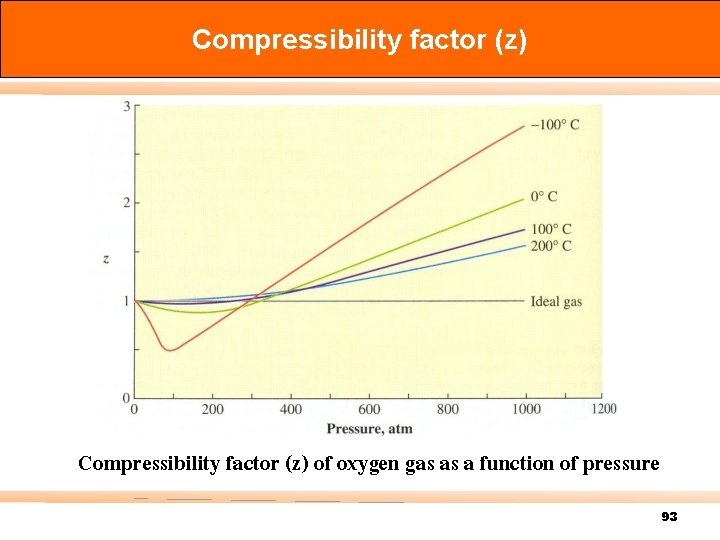
Compressibility factor (z) of oxygen gas as a function of pressure 93

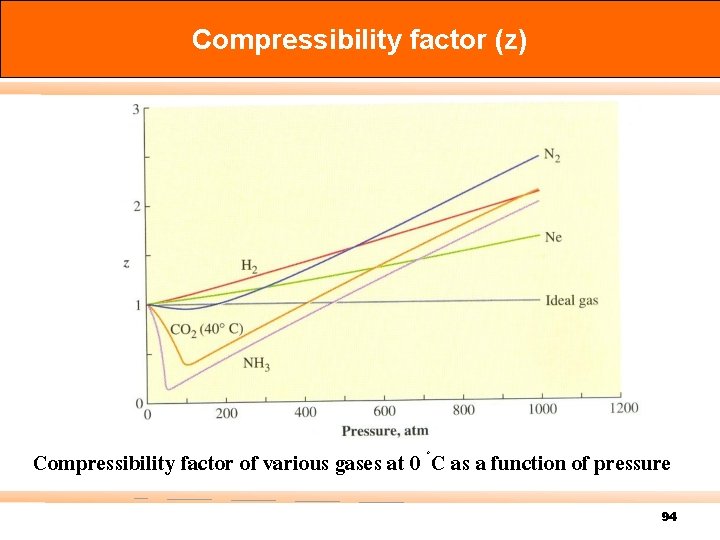
Compressibility factor (z) Compressibility factor of various gases at 0 ◦C as a function of pressure 94



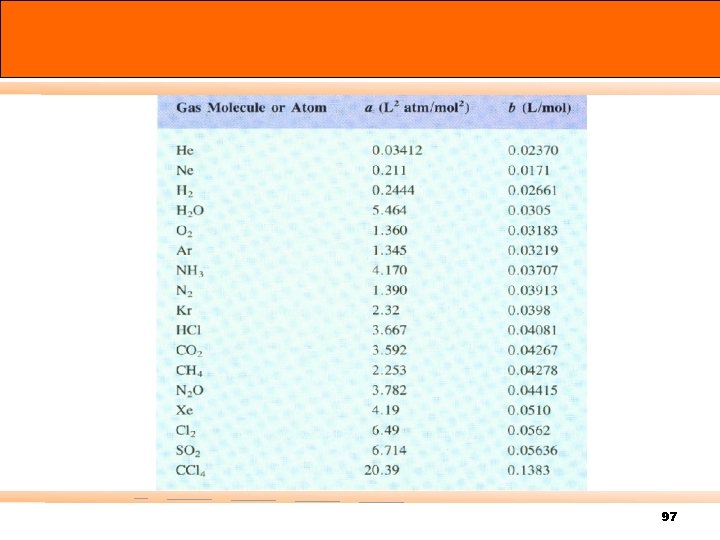
Some values of the van der Waals constants 97



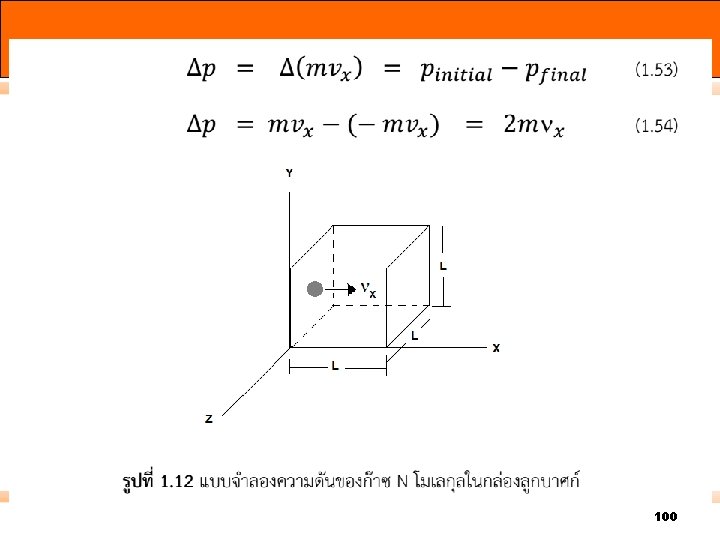
100

101

102

103

104

Boltzmann’s constant 105

Boltzmann’s constant )ตอ ( 106

Barometric Law 107

Barometric Law 108

109

110

111

112



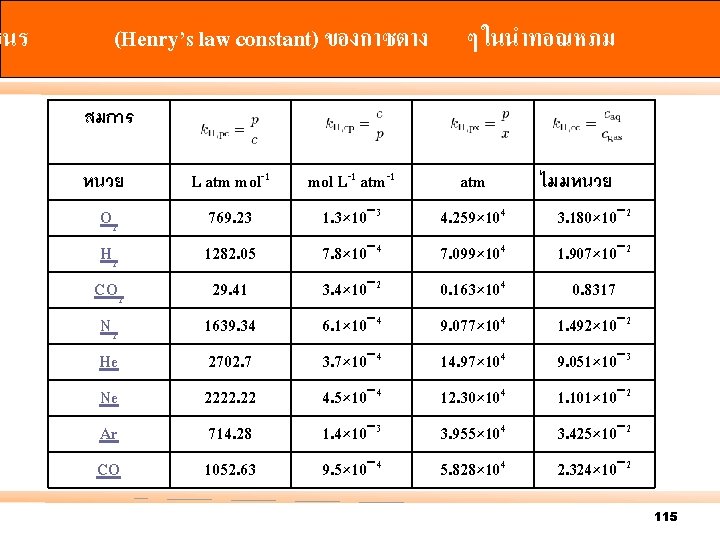
ฮนร (Henry’s law constant) ของกาซตาง ๆ ในนำทอณหภม สมการ O 2 L atm mol-1 769. 23 mol L-1 atm-1 1. 3× 10− 3 atm 4. 259× 104 H 2 CO 2 N 2 He 1282. 05 29. 41 1639. 34 2702. 7 7. 8× 10− 4 3. 4× 10− 2 6. 1× 10− 4 3. 7× 10− 4 7. 099× 104 0. 163× 104 9. 077× 104 14. 97× 104 1. 907× 10− 2 0. 8317 1. 492× 10− 2 9. 051× 10− 3 Ne Ar CO 2222. 22 714. 28 1052. 63 4. 5× 10− 4 1. 4× 10− 3 9. 5× 10− 4 12. 30× 104 3. 955× 104 5. 828× 104 1. 101× 10− 2 3. 425× 10− 2 2. 324× 10− 2 หนวย ไมมหนวย 3. 180× 10− 2 115


117

118




122

![วธทำ ci p MMi RT i 1 0135105 Nm2 48 วธทำ ci = = = [(p MMi) /RT] * i (1. 0135*105 Nm-2) (48](https://slidetodoc.com/presentation_image_h/a96abe042302faf31f41610fd29af27f/image-124.jpg)
วธทำ ci = = = [(p MMi) /RT] * i (1. 0135*105 Nm-2) (48 g mol-1 (* 120 x 10 -9 (8. 314 Nm mol-1 K-1) (298 K) 235. 6 g m 3 - 124


วธทำ i )ppm ( 0. 139= = Ci ( g m-3) / (P * MMi) / (RT) 365= g m-3 * (8. 314 Nm mol-1 K-1) (298 K) (1. 0133*105 Nm-2) ( 64 g mol-1( 0. 139= x 10 -6 ppm 126






Conversion between gravimetric and volumetric units n การเปลยนหนวยจาก 1 ppm เปน mg L-1 ของนำ = 1 volume of pollutant 106 volume of water เปลยนปรมาตรเปนนำหนก d = d of H 2 O = 1 ppm = = = = 1 ppm = m / V 1 kg L-1 1 L of pollutant 106 L of water 1 L x d 106 L of water 1 L x 1 kg/ L 106 L of water 1 kg x (106 mg / 1 kg) 106 L of water 1 mg L-1 132


1 ppm =1 L of pollutant x (MW g / 24. 45 L) x 1, 000 mg / 1 g 103 m 3 of air 1 ppm = MW / 24. 45 mg m-3 หรอ [ppm] = (24. 45 / MW) x [mg m-3] 134

Units for expressing pollutant concentration Source: Colls, J. (1997), Air Pollution 135

คำถาม ? Ex. 1 Convert CO 2 10 ppm to mg m-3 at 25 C, 1 atm Ex. 2 Convert NO 2 50 mg m-3 to ppb at 25 C, 1 atm Ex 3. จงคำนวณความเขมขนของ SO 2 ในรป ppb ถาความเขมขน ของ SO 2 2. 5 mg m-3 136

Ex. 1 Convert CO 2 10 ppm to mg m-3 at 25 C, 1 atm ppm = (MW / 24. 45) mg m-3 1 ppm = 44 / 24. 45 = 1. 80 mg m-3 10 ppm = 1. 80*10 = 18 mg m-3 137

Ex. 2 Convert NO 2 50 mg m-3 to ppb at 25 C, 1 atm ppm = (MW / 24. 45) mg m-3 1 ppm = (46 / 24. 45) = 1. 881 mg m-3 = 1 ppm 50 mg m-3 = 50/1. 881 = 26. 582 ppm 410*2. 658 = 310*26. 582= ppb 138


เอกสารอางอง n พระราชบญญตสงเสรมคณภาพสงแวดลอมแห งชาต พ. ศ. 2535 n Ahrens, C. Donald (1994)Meteorology Today: an introduction to weather, climate and the environment, 5 ed. , West Publishing Company, USA n Birk, James P. (1994) Chemistry, Houghton Mifflin Company, USA, Chpt. 9, pp. 340 -389. 140