1 er Colloque International sur Hydrocarbures Energies et

1 er. Colloque International sur Hydrocarbures, Energies et Environnement (HCEE) Ouargla les 23 et/24 Novembre 2014 Removal of p-Cresol from synthetic wastewater using alginate enrapped turnip peroxidase Ahmed AZIZI, Mahmoud ABOUSEOUD and Afaf AHMEDI University of Medea, University Pole, Laboratory of Biomaterials and Transport Phenomena. Medea, Algeria-26000 Email: aziziahmed 2010@gmail. com
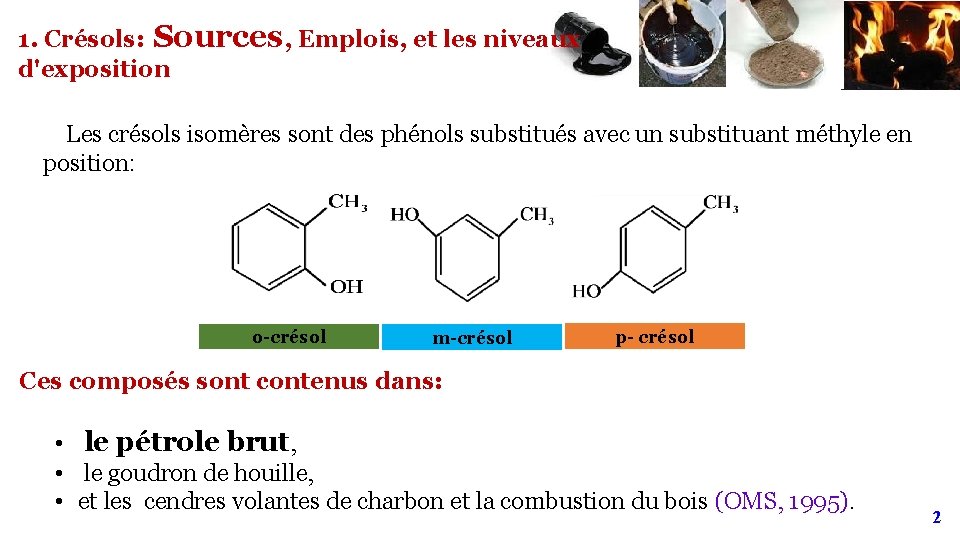
1. Crésols: Sources, Emplois, et les niveaux d'exposition Les crésols isomères sont des phénols substitués avec un substituant méthyle en position: o-crésol m-crésol p- crésol Ces composés sont contenus dans: • le pétrole brut, • le goudron de houille, • et les cendres volantes de charbon et la combustion du bois (OMS, 1995). 2

2. Crésols: Sources, Emplois, et les niveaux d'exposition • o-crésol: solvant . désinfectant. Intermédiaire chimique pour une désodorisant d'odeur et les composés dopants. Produits pharmaceutiques, les parfums, des antioxydants, des colorants, des pesticides et des résines • p-crésol: est utilisé dans la formulation des antioxydants pour les huiles lubrifiantes, des carburants, des polymères, du caoutchouc, des élastomères, les produits alimentaires, les herbicides et d'insecticides. • m-crésol: est utilisé dans la fabrication d'explosifs et dans la production d'herbicides et d'insecticides. 3

3. Crésols: Sources, Emplois, et les niveaux d'exposition • Crésols sont considérés comme toxiques et ont été classés comme polluants dangereux. • Exposition cutanée ou orale chez l'homme, des concentrations élevées de crésols sont: » corrosifs, » absorbé rapidement, » et produisent une toxicité sévère qui peut entraîner la mort. Tel que les limites d’exposition: • Eau usée ≤ 5 ppm (WHO, 1995). • Le corps humaine peut supporter 0, 17 mg/kg masse par jour et 22. 1 mg/m 3 de l’air (WHO. 1996). 4
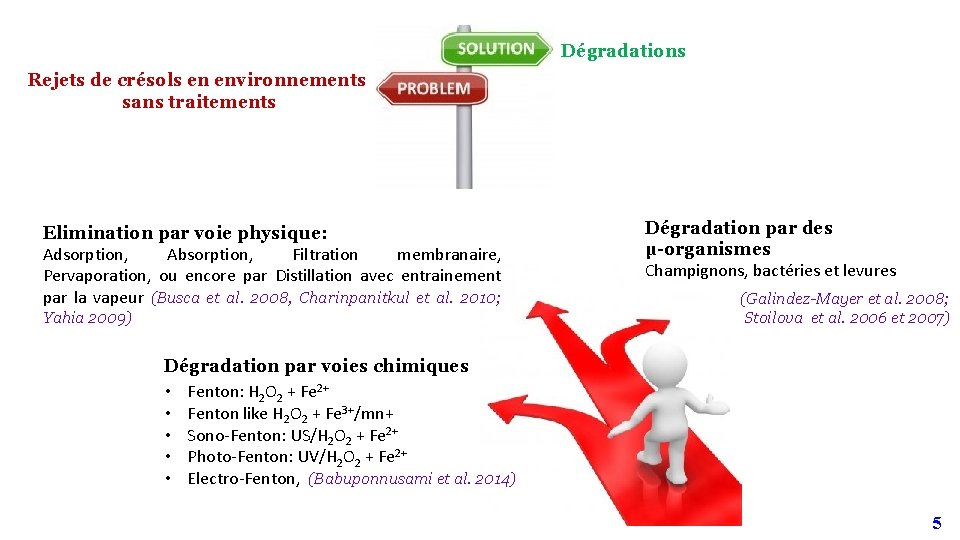
Dégradations Rejets de crésols en environnements sans traitements Elimination par voie physique: Adsorption, Absorption, Filtration membranaire, Pervaporation, ou encore par Distillation avec entrainement par la vapeur (Busca et al. 2008, Charinpanitkul et al. 2010; Yahia 2009) Dégradation par des µ-organismes Champignons, bactéries et levures (Galindez-Mayer et al. 2008; Stoilova et al. 2006 et 2007) Dégradation par voies chimiques • Fenton: H 2 O 2 + Fe 2+ • Fenton like H 2 O 2 + Fe 3+/mn+ • Sono-Fenton: US/H 2 O 2 + Fe 2+ • Photo-Fenton: UV/H 2 O 2 + Fe 2+ • Electro-Fenton, (Babuponnusami et al. 2014) 5
Dégradation par des enzymes , (Neelam Bansal and Shamsher S. Kanwar 2013) • Dégradation par des µ-organismes • Dégradation par voies chimiques • Elimination par voie physique 6
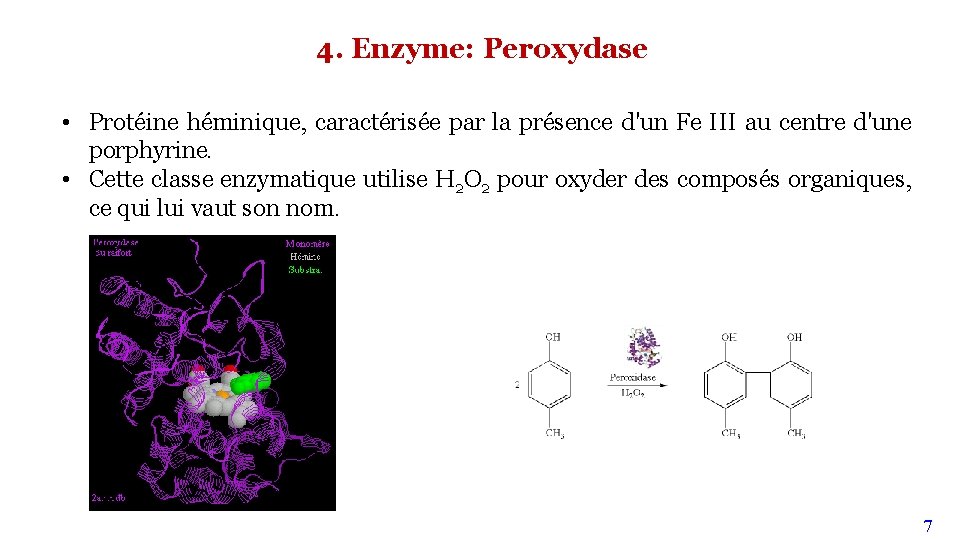
4. Enzyme: Peroxydase • Protéine héminique, caractérisée par la présence d'un Fe III au centre d'une porphyrine. • Cette classe enzymatique utilise H 2 O 2 pour oxyder des composés organiques, ce qui lui vaut son nom. 7

5. Étapes d‘extraction, purification & l’immobilisation de la peroxydase. (1) Extraction (2) Purification (3) Immobilisation EEPP EEB 8
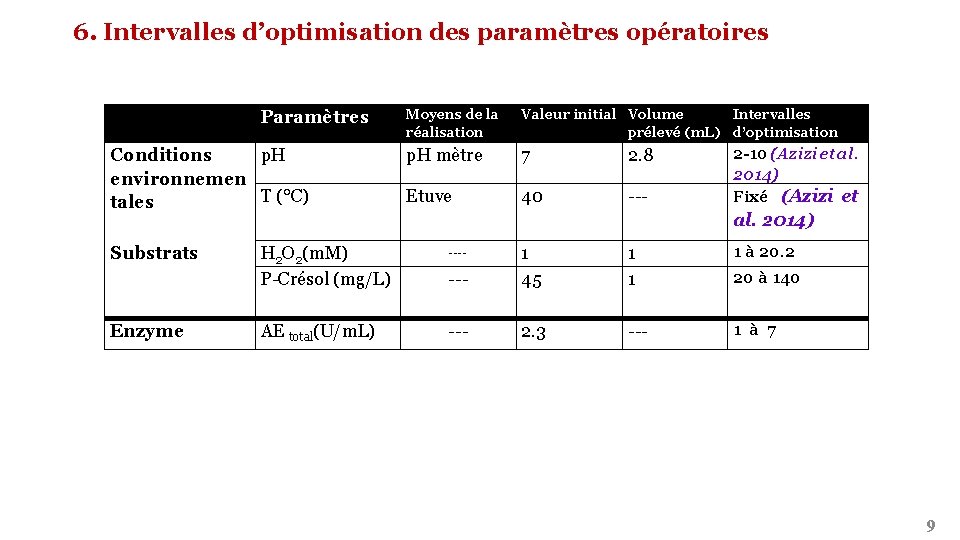
6. Intervalles d’optimisation des paramètres opératoires Paramètres Conditions p. H environnemen T (°C) tales Substrats Enzyme H 2 O 2(m. M) P-Crésol (mg/L) AE total(U/m. L) Moyens de la réalisation Valeur initial Volume Intervalles prélevé (m. L) d’optimisation p. H mètre 7 2. 8 Etuve 40 --- 2 -10 (Azizi et al. 2014) Fixé (Azizi et al. 2014) 1 1 1 à 20. 2 --- 1 45 --- 2. 3 --- 1 à 7 ---- 20 à 140 9
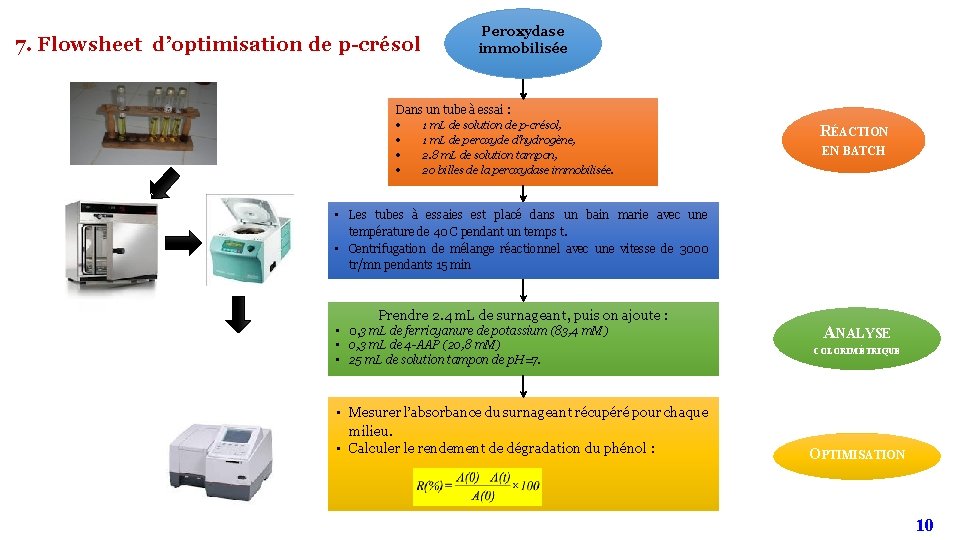
7. Flowsheet d’optimisation de p-crésol Peroxydase immobilisée Dans un tube à essai : 1 m. L de solution de p-crésol, 1 m. L de peroxyde d’hydrogène, 2. 8 m. L de solution tampon, 20 billes de la peroxydase immobilisée. RÉACTION EN BATCH • Les tubes à essaies est placé dans un bain marie avec une température de 40 C pendant un temps t. • Centrifugation de mélange réactionnel avec une vitesse de 3000 tr/mn pendants 15 min Prendre 2. 4 m. L de surnageant, puis on ajoute : • 0, 3 m. L de ferricyanure de potassium (83, 4 m. M) • 0, 3 m. L de 4 -AAP (20, 8 m. M) • 25 m. L de solution tampon de p. H=7. ANALYSE COLORIMÉTRIQUE • Mesurer l’absorbance du surnageant récupéré pour chaque milieu. • Calculer le rendement de dégradation du phénol : OPTIMISATION 10

8. 11
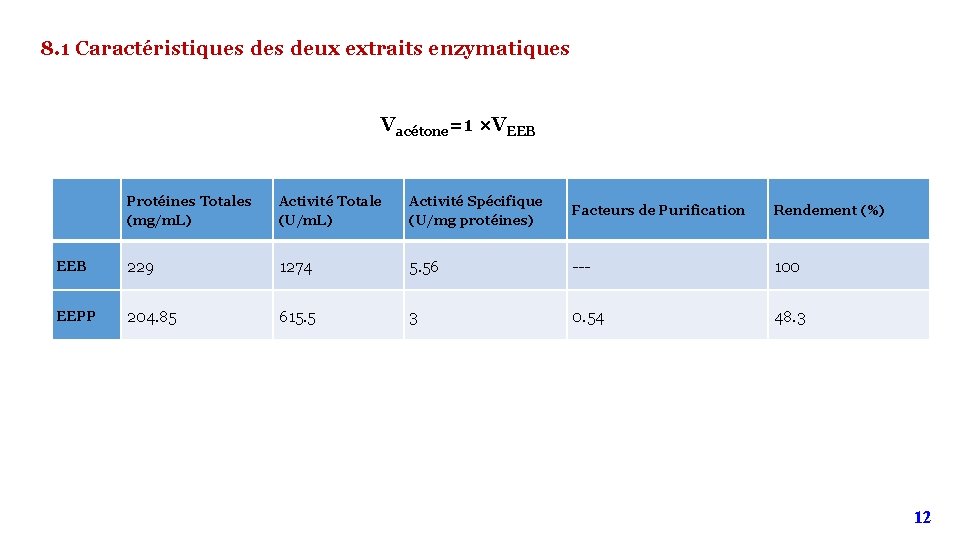
8. 1 Caractéristiques deux extraits enzymatiques Vacétone=1 ×VEEB Protéines Totales (mg/m. L) Activité Totale (U/m. L) Activité Spécifique (U/mg protéines) Facteurs de Purification Rendement (%) EEB 229 1274 5. 56 --- 100 EEPP 204. 85 615. 5 3 0. 54 48. 3 12
![8. 2 [H 2 O 2]optimal ? R=61, 2 % Vmax=0, 6792 m. M/min 8. 2 [H 2 O 2]optimal ? R=61, 2 % Vmax=0, 6792 m. M/min](http://slidetodoc.com/presentation_image_h/37de3cca32467be115217158fd1fce78/image-13.jpg)
8. 2 [H 2 O 2]optimal ? R=61, 2 % Vmax=0, 6792 m. M/min [H 2 O 2]optimal =15. 4 m. M 13
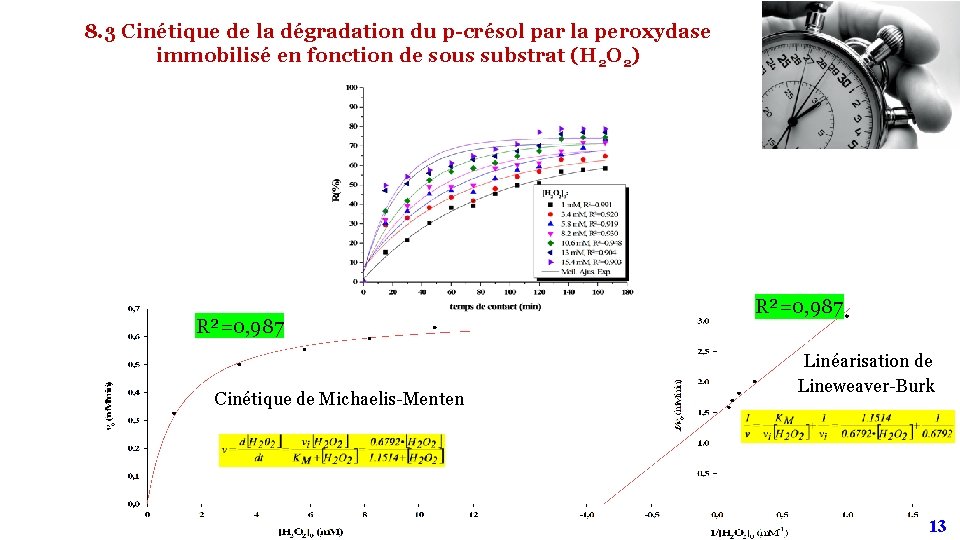
8. 3 Cinétique de la dégradation du p-crésol par la peroxydase immobilisé en fonction de sous substrat (H 2 O 2) R²=0, 987 Cinétique de Michaelis-Menten R²=0, 987 Linéarisation de Lineweaver-Burk 14 13
![8. 4 [Peroxydase]optimal ? R=63, 0 % [Peroxydase]opt= 5 unités/m. L 15 8. 4 [Peroxydase]optimal ? R=63, 0 % [Peroxydase]opt= 5 unités/m. L 15](http://slidetodoc.com/presentation_image_h/37de3cca32467be115217158fd1fce78/image-15.jpg)
8. 4 [Peroxydase]optimal ? R=63, 0 % [Peroxydase]opt= 5 unités/m. L 15
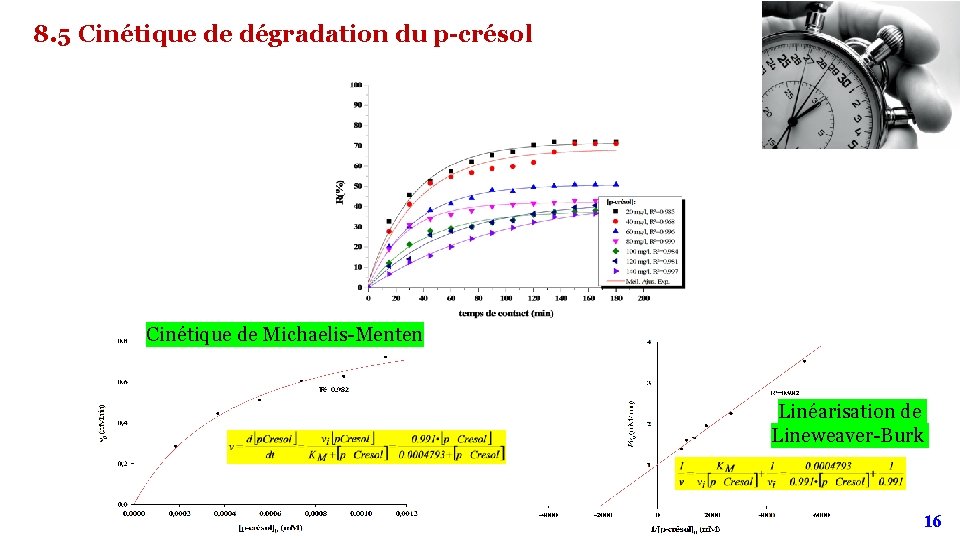
8. 5 Cinétique de dégradation du p-crésol Cinétique de Michaelis-Menten Linéarisation de Lineweaver-Burk 16
![8. 6 [p-crésol]optimal ? temps de contact ? R=71, 1 % [p-Crésol]= 40 mg/L 8. 6 [p-crésol]optimal ? temps de contact ? R=71, 1 % [p-Crésol]= 40 mg/L](http://slidetodoc.com/presentation_image_h/37de3cca32467be115217158fd1fce78/image-17.jpg)
8. 6 [p-crésol]optimal ? temps de contact ? R=71, 1 % [p-Crésol]= 40 mg/L vmax=0. 991 m. M/min temps de contact=135 min 17
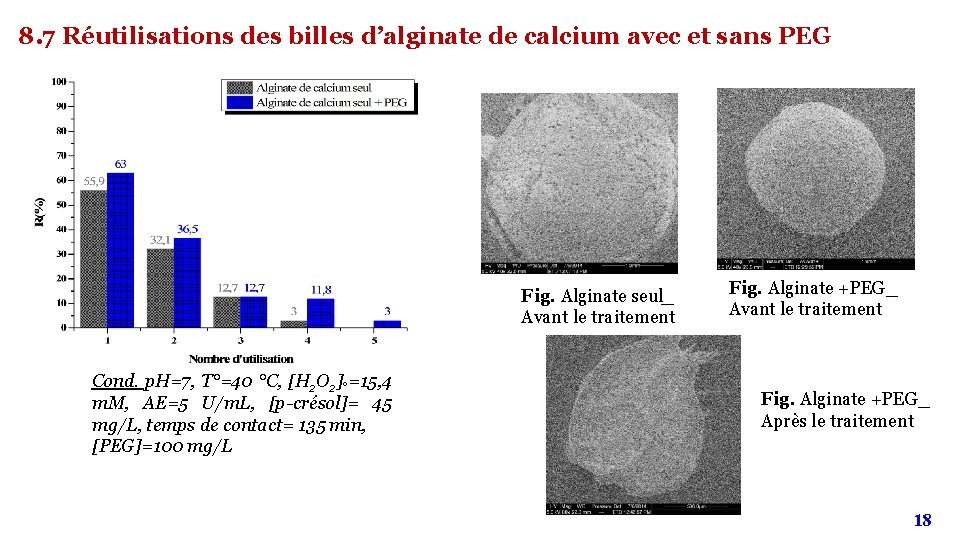
8. 7 Réutilisations des billes d’alginate de calcium avec et sans PEG Fig. Alginate seul_ Avant le traitement Cond. p. H=7, T°=40 °C, [H 2 O 2]°=15, 4 m. M, AE=5 U/m. L, [p-crésol]= 45 mg/L, temps de contact= 135 min, [PEG]=100 mg/L Fig. Alginate +PEG_ Avant le traitement Fig. Alginate +PEG_ Après le traitement 18
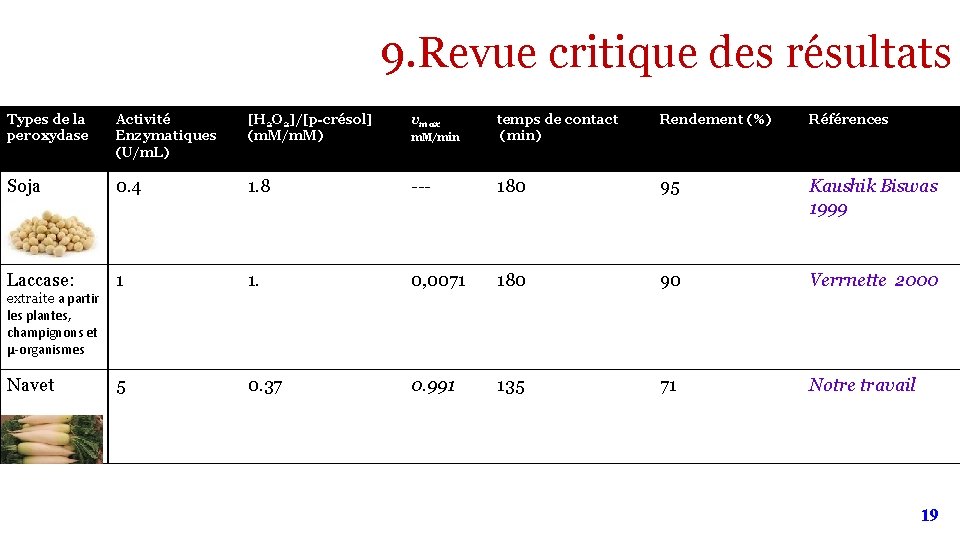
9. Revue critique des résultats Types de la peroxydase Activité Enzymatiques (U/m. L) [H 2 O 2]/[p-crésol] (m. M/m. M) vmax Rendement (%) Références m. M/min temps de contact (min) Soja 0. 4 1. 8 --- 180 95 Kaushik Biswas 1999 1 1. 0, 0071 180 90 Verrnette 2000 5 0. 37 0. 991 135 71 Notre travail Laccase: extraite a partir les plantes, champignons et µ-organismes Navet 19

10. • Un rendement de dégradation acceptable (71 %) a été obtenu après l’optimisation de: » [H 2 O 2]= 15. 4 m. M, » AE= 5 U/m. L, » [p-crésol]= 40 mg/L, » temps de contact= 135 min. Avec [H 2 O 2]/[p-crésol]=0, 37 et vmax=0. 99 m. M/min • Faible rentabilité de la peroxydase immobilisée par l’aginate de calcium seul ou avec le PEG. 20

11. Perspectives & recommandations • Re-optimiser et stabiliser le support d’encapsulation, • Généraliser le traitement par la peroxydase encapsulé des autres isomères de p-crésol, • Conception d’un réacteur enzymatique, • Exécution de ce procédé sur le traitement des effluents industriels contenants les crésols. 21

22
- Slides: 22