1 Equilibri acidobase seconda parte 2 Forza relativa

1 Equilibri acido-base (seconda parte)

2 Forza relativa di acidi e basi Ka>>1 Questa reazione si può considerare anche in funzione della forza relativa tra HCl e H 3 O+. HCl perde più facilmente H+ rispetto ad H 3 O+ e quindi è un acido più forte di H 3 O+ (infatti l’equilibrio è molto spostato verso destra) Ka<<1 In questo caso solo 1% delle molecole di CH 3 COOH sono ionizzate. Questo vuol dire che H 3 O+ è un acido più forte di CH 3 COOH (infatti l’equilibrio è spostato a sinistra). Ciò vuol anche dire che CH 3 COO- è base più forte di H 2 O.

3 Forza relativa di acidi e basi base più forte
Forza relativa di acidi e basi acidi forti 4
5 Effetto livellante del solvente Gli acidi forti in H 2 O sono tutti ionizzati al 100%. Questo perché sono tutti acidi più forti di H 3 O+. E’ quindi impossibile misurare la loro forza acida relativa utilizzando H 2 O come solvente. Se usiamo un solvente meno basico di H 2 O (es. un acido debole come acido acetico) si può notare una differenza. HX + Solv. H+ + X- Ka>>1 Ka<<1 acido forte acido debole Per Solv=acido acetico si osserva che gli acidi forti HCl. O 4, HNO 3 e HCl non sono completamente dissociati, ma alcuni sono più dissociati di altri. Ovvero la loro forza acida varia: HCl. O 4 > HNO 3 > HCl Effetto livellante dell’acqua sugli acidi forti: forti tutti gli acidi forti sono completamente dissociati in H 2 O e quindi la loro forza sembra essere la stessa

Forza degli acidi e struttura molecolare 6 legame, più facile è rimuovere il protone

Forza degli acidi e struttura molecolare 7 Effetto della forza del legame H-X: Forza degli acidi alogenidrici HX (VII gruppo) è: L’elettronegatività di X diminuisce lungo il gruppo e quindi la polarità del legame è più alta per HF e più bassa per HI. Nonostante questo le dimensioni di X aumentano lungo il gruppo (e quindi il legame si indebolisce) ed è questo secondo fattore a prevalere, facendo aumentare la forza acida da HF ad HI Effetto della polarità del legame H-X: Forza acida dei composti Hn. X lungo il 2 periodo: All’aumentare dell’elettronegatività di X andando da sinistra a destra lungo il periodo la forza acida aumenta

Forza degli acidi e struttura molecolare 8 La struttura degli ossiacidi è del tipo: X-O-H In cui l’atomo X è spesso legato ad altri atomi di ossigeno o gruppi OH (es. HCl. O 4 o. H 2 SO 4). In questo caso è solo la polarità del legame O-H che determina l’acidità e questa aumenta con l’elettronegatività dell’atomo X 1. A parità di formula di struttura la forza acida aumenta all’aumentare dell’elettronegatività dell’elemento non metallico X Esempio: gli acidi HXO (ipo “radice alogeno”-oso)
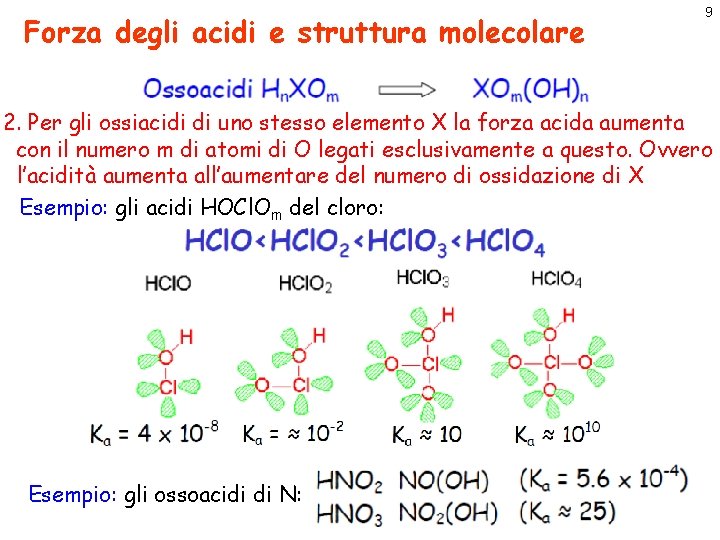
Forza degli acidi e struttura molecolare 9 2. Per gli ossiacidi di uno stesso elemento X la forza acida aumenta con il numero m di atomi di O legati esclusivamente a questo. Ovvero l’acidità aumenta all’aumentare del numero di ossidazione di X Esempio: gli acidi HOCl. Om del cloro: Esempio: gli ossoacidi di N:
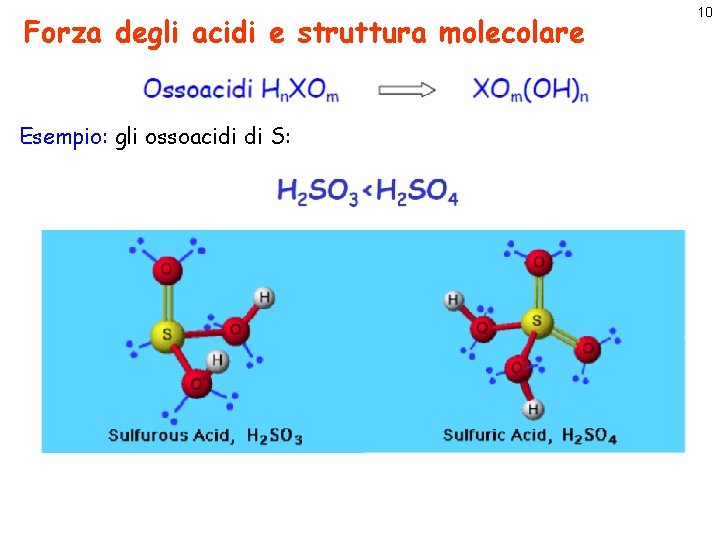
Forza degli acidi e struttura molecolare Esempio: gli ossoacidi di S: 10

Struttura e forza acida degli ossiacidi: schema 11 riassuntivo
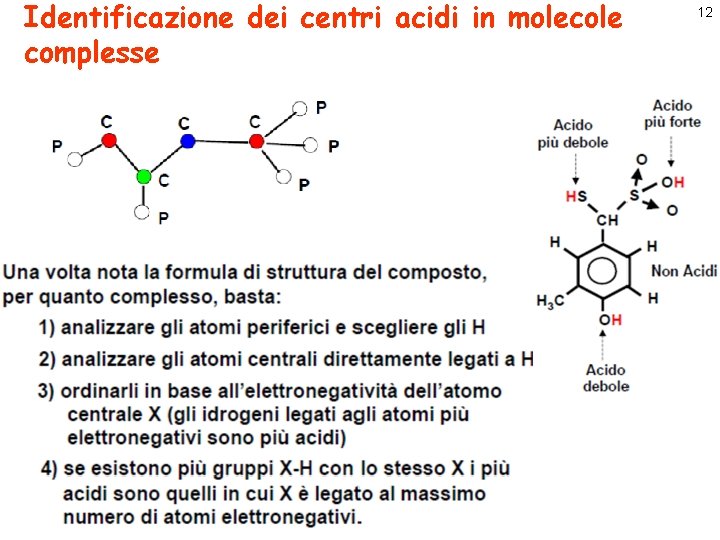
Identificazione dei centri acidi in molecole complesse 12

Forza degli acidi poliprotici 13

Idrolisi di sali Cosa succede al p. H quando sciogliamo un SALE in acqua? Osservazione sperimentale: quindi alcuni sali hanno carattere acido o basico 14

15 Idrolisi di sali I cationi e gli anioni dei sali sono acidi e basi tanto più forti quanto più deboli sono le basi e gli acidi ad essi coniugati. In acqua daranno le relative reazioni di dissociazione: Seguite dalle reazioni di idrolisi (reazioni acido-base con H 2 O) dei cationi ed anioni generati

16 Idrolisi di sali p. H di soluzioni acquose di sali derivanti da acido forte+base forte idrolisi dello ione Na+ praticamente ! idrolisi dello ione Clpraticamente ! Soluzioni di sali derivanti da acidi e basi FORTI sono neutre

17 Idrolisi di sali p. H di soluzioni acquose di sali derivanti da base forte+acido debole Già visto prima: Na+ non dà reazione di idrolisi acida Fidrolisi basica dello ione F- Soluzioni di sali derivanti da basi FORTI e acidi DEBOLI sono basiche

18 Idrolisi di sali p. H di soluzioni acquose di sali derivanti da base debole+acido forte Già visto prima: Cl- non dà reazione di idrolisi basica idrolisi acida dello ione NH 4+ Soluzioni di sali derivanti da basi DEBOLI e acidi FORTI sono acide

19 Idrolisi di sali p. H di soluzioni acquose di sali derivanti da base debole+acido debole Si ha competizione tra un acido debole e una base (un po’ più debole rispetto alla forza dell’acido). Vince in ogni caso la specie più forte e quindi la soluzione acquosa di NH 4 F è debolmente acida Soluzioni di sali derivanti da basi DEBOLI e acidi DEBOLI sono: acide se Ka > Kb basiche se Kb > Ka

Idrolisi di Sali: riassunto 20 Il calcolo del p. H di una soluzione di un sale che dà idrolisi acida o basica si esegue come visto per il caso di un acido debole o di una base debole. Da tenere presente che le costanti di idrolisi basica di anioni di acidi deboli (cosi quelle di idrolisi acida di cationi di basi deboli) non sono riportate nelle tabelle perché legate dalla relazione: dove Ka e Kb sono le costanti di dissociazione acida e basica di una coppia coniugata acido-base

Idrolisi di Sali: esempio Esempio: Calcolare il p. H di una soluzione 0. 050 M di NH 4 Cl sapendo che Kb(NH 3) = 1. 8 10 -5 21

22 Idrolisi di Sali: esempio p. H < 7 soluzione acida (come prevedibile)

Soluzioni tampone 23

Soluzioni tampone 24

Soluzioni tampone: comportamento per aggiunta 25 di acido

Soluzioni tampone: comportamento per aggiunta 26 di base

Soluzioni tampone: potere tamponante 27

p. H di una soluzione tampone 28

p. H di una soluzione tampone 29

p. H di una soluzione tampone 30

p. H di una soluzione tampone 31 conc. analitica Cb conc. analitica Ca

Progettazione di una soluzione tampone 32
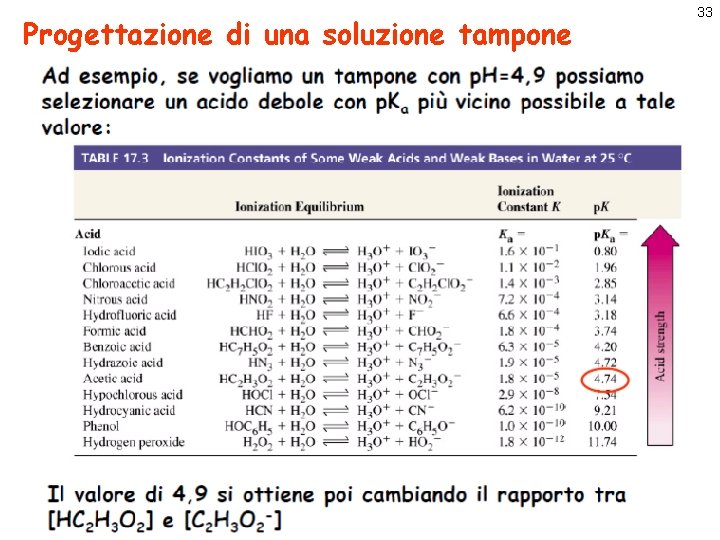
Progettazione di una soluzione tampone 33

Progettazione di una soluzione tampone 34

35 Soluzioni tampone: esempio 1 Calcolare il p. H di una soluzione tampone che contiene acido acetico CH 3 COOH 0. 10 M e acetato di sodio CH 3 COONa 0. 20 M. La Ka dell’acido acetico è 1. 7 x 10 -5 Soluzione: 0 0

Soluzioni tampone: esempio 2 36 Calcolare il p. H di una soluzione tampone che contiene ammoniaca NH 3 0. 10 M e cloruro di ammonio NH 4 Cl 0. 20 M. La Kb dell’ammoniaca è 1. 8 x 10 -5 Soluzione: 0 0

Soluzioni tampone: esempio 3 37 Calcolare il rapporto tra la concentrazione di acido acetico e di ione acetato necessari per preparare una soluzione tampone con p. H=4. 9. p. Ka dell’acido acetico è 4. 77 Soluzione: 0 0

Tamponi fosfato 38

Tamponi fosfato 39

Tamponi fosfato 40

Metodi di preparazione di un tampone 41

Soluzioni tampone: riassunto su comportamento per aggiunta di acido o base Se aggiungo una base ([OH-]): Se aggiungo un acido ([H 3 O+]): 42
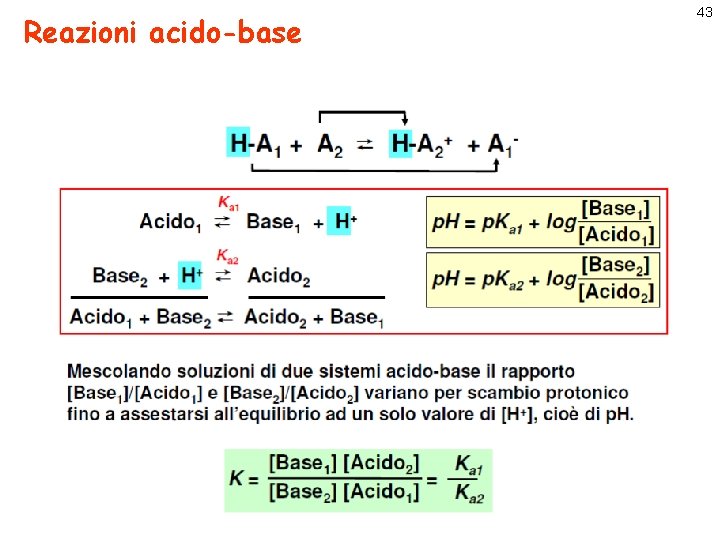
Reazioni acido-base 43

Previsioni della direzione di reazioni acido-base 44

Titolazioni acido-base 45

Titolazione di acido forte con base forte 1000 mmol 1000 46

Titolazione di acido forte con base forte 47

Titolazione di acido forte con base forte 48 Si ha un eccesso di OH- e il p. H diventa basico Punto di viraggio (o di fine titolazione): punto in cui si ha una variazione brusca di un parametro fisico, il più possibile vicino al punto di equivalenza
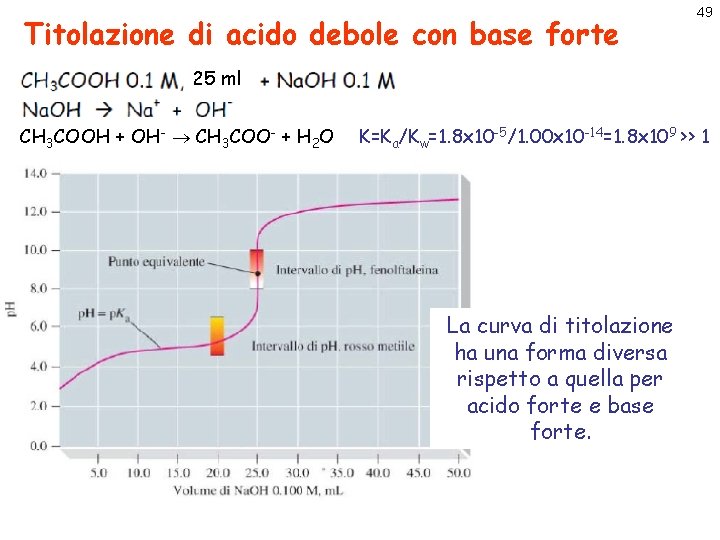
Titolazione di acido debole con base forte 49 25 ml CH 3 COOH + OH- CH 3 COO- + H 2 O K=Ka/Kw=1. 8 x 10 -5/1. 00 x 10 -14=1. 8 x 109 >> 1 La curva di titolazione ha una forma diversa rispetto a quella per acido forte e base forte.
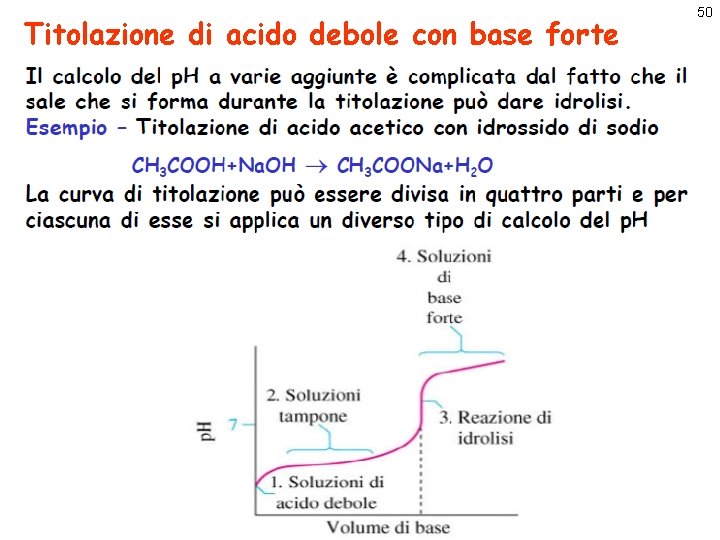
Titolazione di acido debole con base forte 50

Titolazione di acido debole con base forte Inizio: V(Na. OH) = 0 ml Soluzione di acido acetico 0. 1 M si calcola considerando l’equilibrio CH 3 COOH + OH- CH 3 COO- + H 2 O Aggiunta: V(Na. OH) = 10 ml Si forma una soluzione n. Ac-=n. OH-=0. 1 x 10/1000=1. 0 x 10 -3 con: n. HAc=n 0 HAc-n. Ac-=0. 1 x 25/1000 -1. 0 x 10 -3 = = 2. 5 x 10 -3 -1. 0 x 10 -3 =1. 5 x 10 -3 Vtot=V 0+V(Na. OH)=25+10=35 ml [Ac-] =1. 0 x 10 -3/0. 035=0. 0286 Si tratta di una soluzione tampone: [HAc] =1. 5 x 10 -3/0. 035=0. 0429 p. H=p. Ka+log [Ac-] [HAc] =4. 74+log 0. 0286 0. 0429 =4. 74+log 0. 6667=4. 56 51

Titolazione di acido debole con base forte Aggiunta: V(Na. OH) = 12. 5 ml 52 CH 3 COOH + OH- CH 3 COO- + H 2 O n. Ac-=n. OH-=0. 1 x 12. 5/1000=1. 25 x 10 -3 n. HAc=n 0 HAc-n. Ac-=0. 1 x 25/1000 -1. 25 x 10 -3=2. 5 x 10 -3 -1. 25 x 10 -3 =1. 25 x 10 -3 Vtot=V 0+V(Na. OH)=25+12. 5=37. 5 ml [Ac-] =1. 25 x 10 -3/0. 0375 = 0. 033 [HAc] =1. 25 x 10 -3/0. 0375 = 0. 033 [Ac-] =4. 74+log 1=4. 74 p. H=p. Ka+log [HAc] Si tratta di una soluzione tampone equimolecolare: E’ un punto caratteristico della curva di titolazione, detto punto di semiequivalenza Il valore del p. H in questo punto permette di determinare il valore di Ka, dato che p. H=p. Ka

Titolazione di acido debole con base forte 53 CH 3 COOH + OH- CH 3 COO- + H 2 O Aggiunta: V(Na. OH) = 25 ml n. Ac-=n. OH-=0. 1 x 25/1000=2. 5 x 10 -3 n. HAc=0 Tutte le moli di HAc inizialmente presenti si sono trasformate in Ac -, si ha quindi una soluzione acquosa di acetato di sodio. Questo sale deriva da un acido debole + base forte e dà idrolisi basica per cui la soluzione non è neutra Vtot=V 0+V(Na. OH)=25+25=50 ml [Ac-]0 =2. 5 x 10 -3/0. 050 = 0. 033 [OH-] = Kb [Ac-]0= 5. 6 x 10 -10 0. 033 = 1. 848 x 10 -11 = 4. 3 x 10 -6 p. OH=-log(4. 3 x 10 -6) = 5. 37 p. H = 14 - p. OH = 8. 63 E’ il punto di equivalenza. Il p. H è > 7 per via dell’idrolisi dell’anione acetato

Titolazione di acido debole con base forte CH 3 COOH + OH- CH 3 COO- + H 2 O Aggiunta: V(Na. OH) > 25 ml Si ha un eccesso di base forte: n. OH-=0. 1 x. V(Na. OH) - 0. 1 x 25 Vtot=V 0+V(Na. OH)=25+V(Na. OH) [OH-] =n. OH-/Vtot = [0. 1 V(Na. OH)-2. 5] /[25+V(Na. OH)] Per V(Na. OH) [OH-] = 0. 1 ovvero p. H = 13 54
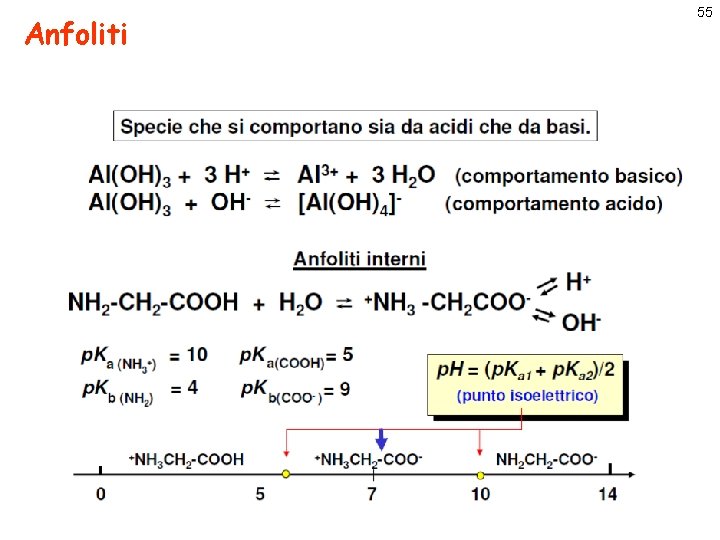
Anfoliti 55

Gli amminoacidi: anfoliti interni importanti in biologia Gli aminoacidi sono tutti degli elettroliti deboli e, a parte la prolina, hanno una formula generale RCH(NH 2)COOH Avendo quindi sia un gruppo carbossilico (COOH) sia un gruppo amminico (-NH 2), sono ionizzati a tutti i valori di p. H. Ciò significa che possono esistere o come cationi, cationi o come anioni o come ione dipolare o sale interno (forma zwitterionica). zwitterionica Il p. H in cui la concentrazione del catione e dell’anione sono uguali si dice punto isoelettrico Tale punto si può calcolare uguagliando le concentrazioni dell'anione e del catione quali risultano dalle costanti di equilibrio. Si ottiene: p. H = (p. Ka 1+p. Ka 2)/2 56

Calcoli sul p. H di acidi e basi in acqua 57
- Slides: 57