1 Curtis et al Il nuovo Invito alla

























- Slides: 26

1 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

H. Curtis, N. S. Barnes, A. Schnek, A. Massarini, G. Valitutti, M. Falasca, P. Amadio Il nuovo Invito alla biologia. blu 2 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Capitolo 5 Gli atomi, i legami e le reazioni 3 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Lezione 1 Le particelle dell’atomo 4 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Protoni, neutroni ed elettroni Gli atomi di tutti gli elementi sono formati da tre particelle fondamentali: • elettrone: carica negativa, massa pari a – 1, 6 10 -19 C; • protone: carica positiva, massa pari a +1, 6 10 -19 C; • neutrone: priva di carica elettrica, massa poco superiore a quella del protone. 5 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

I nucleoni Ogni atomo contiene un nucleo, cioè una zona molto piccola e densa in cui sono confinati i protoni e i neutroni: a tali particelle si dà il nome di nucleoni. 6 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il numero atomico Il numero di protoni presenti nel nucleo di un atomo si chiama numero atomico (Z). Se l’atomo è neutro, questo numero è uguale a quello degli elettroni. 7 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Gli isotopi sono atomi dello stesso elemento aventi le stesse proprietà chimiche ma masse diverse, perché contengono un diverso numero di neutroni. 8 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il numero di massa (A) è uguale alla somma del numero di protoni (Z) e del numero di neutroni (N) contenuti nel nucleo: A = Z + N Conoscendo il numero atomico e il numero di massa di un elemento si può calcolare il numero di neutroni contenuti nel suo nucleo: N = A − Z 9 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Lezione 2 La distribuzione degli elettroni nell’atomo 10 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Livelli di energia e configurazione elettronica Gli elettroni si distribuiscono nell’atomo in base a definiti livelli di energia. La disposizione degli elettroni, in un atomo o in uno ione, è detta configurazione elettronica. Il primo livello energetico contiene al massimo 2 elettroni, il secondo e il terzo contengono al massimo 8 elettroni. 11 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Gli elettroni di valenza Quando gli atomi si avvicinano per formare un legame chimico solo gli elettroni più esterni partecipano all’operazione. Gli elettroni dello strato più esterno vengono chiamati elettroni di valenza o di legame. 12 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il legame chimico permette agli atomi di unirsi per formare molecole, o agli ioni di carica opposta di esercitare un’attrazione reciproca tra loro. 13 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

La regola dell’ottetto I gas nobili sono stabili perché hanno otto elettroni (due nel caso dell’elio) nello strato di valenza, che quindi è completo. La regola dell’ottetto dice che un atomo è particolarmente stabile quando ha 8 elettroni nello strato di valenza, cioè ha lo strato di valenza completo. 14 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Lezione 3 I legami chimici 15 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

I legami chimici si formano perché gli atomi cercano di raggiungere la configurazione elettronica esterna più stabile, cioè l’ottetto. 16 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il legame covalente puro Il legame covalente si forma quando due atomi mettono in comune una coppia di elettroni. Se i due atomi sono identici e gli elettroni di legame sono attratti con la stessa forza il legame è covalente puro. 17 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il legame covalente polare Atomi di natura diversa possono mettere in compartecipazione i loro elettroni di valenza, ma esercitano sugli elettroni di legame una diversa forza attrattiva e si forma così un legame covalente polare. 18 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Legami singoli, doppi e tripli Il legame covalente è: • singolo se è condivisa una sola coppia di elettroni; • doppio se sono condivise due coppie di elettroni; • triplo se sono condivise tre coppie di elettroni. 19 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

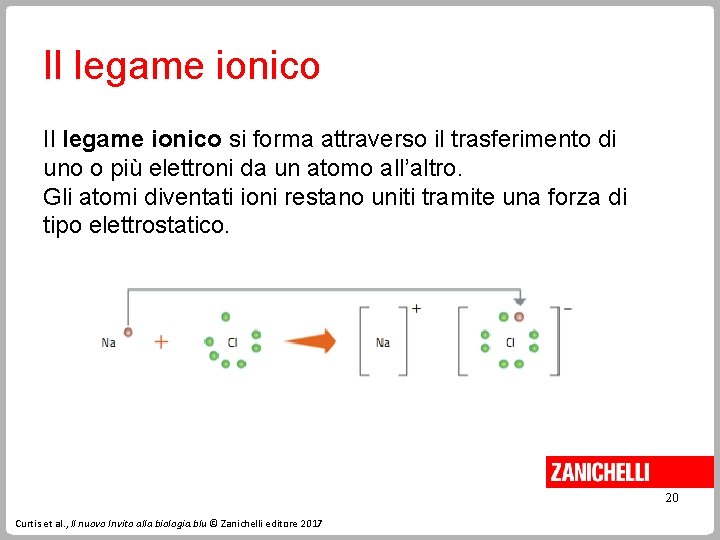
Il legame ionico si forma attraverso il trasferimento di uno o più elettroni da un atomo all’altro. Gli atomi diventati ioni restano uniti tramite una forza di tipo elettrostatico. 20 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Il legame metallico avviene tra gli atomi delle sostanze semplici metalliche ed è un legame cooperativo. Gli atomi metallici mettono in comune gli elettroni di valenza, che vengono condivisi tra più nuclei. Si forma così un flusso elettronico chiamato marea o colla elettronica. 21 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Lezione 4 Rappresentare le reazioni chimiche 22 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Le equazioni chimiche Ogni reazione chimica si può rappresentare con una equazione chimica. Una reazione (o equazione) chimica è una trasformazione di sostanze dette reagenti in altre sostanze dette prodotti. 23 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Bilanciare una reazione /1 Per rispettare la legge di conservazione della massa la reazione deve essere bilanciata aggiungendo dei coefficienti stechiometrici davanti alle formule di reagenti e prodotti. Con i coefficienti stechiometrici è possibile mantenere, per ciascuna specie, l’uguaglianza tra il numero di atomi dei reagenti e dei prodotti. 24 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Bilanciare una reazione /2 Per scrivere una equazione di reazione bisogna • stabilire quali sono reagenti e prodotti; • scrivere le formule esatte dei reagenti e dei prodotti; • bilanciare la reazione, ponendo davanti alle molecole gli opportuni coefficienti stechiometrici fino al raggiungimento dell’uguaglianza degli atomi in gioco. 25 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017

Le regole del bilanciamento Per bilanciare una reazione si seguono le seguenti regole: 1. per primi si bilanciano gli atomi dei metalli e dei non metalli; 2. si bilanciano gli ioni poliatomici, come fossero un unico gruppo di atomi; 3. si bilanciano per ultimi gli atomi di idrogeno e di ossigeno se presenti. 26 Curtis et al. , Il nuovo Invito alla biologia. blu © Zanichelli editore 2017
 Curtis et al
Curtis et al Letra para que mi amor no sea un sentimiento
Letra para que mi amor no sea un sentimiento Cancion banderita española
Cancion banderita española Invito a pregare
Invito a pregare Nadie pudo venir
Nadie pudo venir Diotrefes
Diotrefes Te invito a jugar uno
Te invito a jugar uno Realidades 2 capítulo 3a
Realidades 2 capítulo 3a Te invito a mi casa esta navidad
Te invito a mi casa esta navidad Te invito un vino
Te invito un vino Tiene merito y es justo ganar con trampas
Tiene merito y es justo ganar con trampas Irregular preterite venir poner decir and traer
Irregular preterite venir poner decir and traer Il quinto libro del nuovo testamento
Il quinto libro del nuovo testamento Rebibbia nuovo complesso
Rebibbia nuovo complesso Per vino nuovo otri nuovi
Per vino nuovo otri nuovi Nuovo reverse charge in edilizia casi risolti
Nuovo reverse charge in edilizia casi risolti Aprite le finestre al nuovo sole
Aprite le finestre al nuovo sole Il quinto libro del nuovo testamento
Il quinto libro del nuovo testamento Quadro orario alberghiero nuovo ordinamento
Quadro orario alberghiero nuovo ordinamento Eleison verbo greco
Eleison verbo greco Cielo nuovo è la tua parola
Cielo nuovo è la tua parola Valutazione delle partecipazioni
Valutazione delle partecipazioni Tempo misto coscienza di zeno
Tempo misto coscienza di zeno Corriente
Corriente Nuovo codice appalti cosa cambia
Nuovo codice appalti cosa cambia Open day berti
Open day berti Eleia italia
Eleia italia

















































