1 CHMIA PRE 2 RO GYMNZI Medzi elektrofiln
- Slides: 3

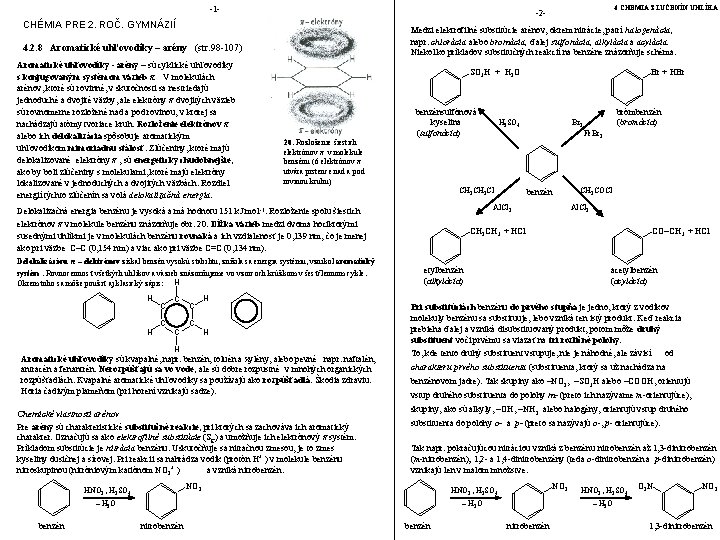
-1 - CHÉMIA PRE 2. ROČ. GYMNÁZIÍ Medzi elektrofilné substitúcie arénov, okrem nitrácie, patrí halogenácia, napr. chlorácia alebo bromácia, ďalej sulfonácia, alkylácia a acylácia. Niekoľko príkladov substitučných reakcií na benzéne znázorňuje schéma: 4. 2. 8 Aromatické uhľovodíky – arény (str. 98 -107) Aromatické uhľovodíky - arény – sú cyklické uhľovodíky s konjugovaným systémom väzieb π. V molekulách arénov, ktoré sú rovinné, v skutočnosti sa nestriedajú jednoduché a dvojité väzby, ale elektróny π dvojitých väzieb sú rovnomerne rozložené nad a pod rovinou, v ktorej sa nachádzajú atómy tvoriace kruh. Rozloženie elektrónov π alebo ich delokalizácia spôsobuje aromatickým uhľovodíkom mimoriadnu stálosť. Zlúčeniny, ktoré majú delokalizované elektróny π , sú energeticky chudobnejšie, ako by boli zlúčeniny s molekulami, ktoré majú elektróny lokalizované v jednoduchých a dvojitých väzbách. Rozdiel energií týchto zlúčenín sa volá delokalizačná energia. SO 3 H + H 2 O benzénsulfónová kyselina (sulfonácia) Delokalizáciou π – elektrónov získal benzén vysokú stabilitu, znížila sa energia systému, vznikol aromatický systém. Rovnocennosť všetkých uhlíkov a väzieb znázorňujeme vo vzorcoch krúžkom v šesťčlennom cykle. Okrem toho sa môže použiť aj klasický zápis: H H C C C H Aromatické uhľovodíky sú kvapalné, napr. benzén, toluén a xylény, alebo pevné napr. naftalén, antracén a fenantrén. Nerozpúšťajú sa vo vode, ale sú dobre rozpustné v mnohých organických rozpúšťadlách. Kvapalné aromatické uhľovodíky sa používajú ako rozpúšťadlá. Škodia zdraviu. Horia čadivým plameňom (pri horení vznikajú sadze). Chemické vlastnosti arénov Pre arény sú charakteristické substitučné reakcie, pri ktorých sa zachováva ich aromatický charakter. Označujú sa ako elektrofilné substitúcie (SE) a umožňuje ich elektrónový π systém. Príkladom substitúcie je nitrácia benzénu. Uskutočňuje sa nitračnou zmesou, je to zmes kyseliny dusičnej a sírovej. Pri reakcii sa nahrádza vodík (protón H+ ) v molekule benzénu nitroskupinou (nitróniovým katiónom NO 2+ ) a vzniká nitrobenzén: benzén Al. Cl 3 CO–CH 3 + HCl etylbenzén (alkylácia) acetylbenzén (acylácia) Pri substitúciách benzénu do prvého stupňa je jedno, ktorý z vodíkov molekuly benzénu sa substituuje, lebo vzniká ten istý produkt. Keď reakcia prebieha ďalej a vzniká disubstituovaný produkt, potom môže druhý substituent voči prvému sa viazať na tri rozličné polohy. To, kde tento druhý substituent vstupuje, nie je náhodné, ale závisí od charakteru prvého substituenta (substituenta, ktorý sa už nachádza na benzénovom jadre). Tak skupiny ako –NO 2, –SO 3 H alebo –COOH, orientujú vstup druhého substituenta do polohy m- (preto ich nazývame m-orientujúce), skupiny, ako sú alkyly, –OH, –NH 2 alebo halogény, orientujú vstup druhého substituenta do polohy o- a p- (preto sa nazývajú o-, p- orientujúce). Tak napr. pokračujúcou nitráciou vzniká z benzénu nitrobenzén až 1, 3 -dinitrobenzén (m-nitrobenzén); 1, 2 - a 1, 4 -dinitrobenzény (teda o-dinitrobenzén a p-dinitrobenzén) vznikajú len v malom množstve. NO 2 HNO 3 , H 2 SO 4 – H 2 O nitrobenzén CH 3 COCl CH 2 CH 3 + HCl – H 2 O benzén brómbenzén (bromácia) Br 2 Fe. Br 3 CH 3 CH 2 Cl NO 2 HNO 3 , H 2 SO 4 H C C Br + HBr 20. Rozloženie šiestich elektrónov π v molekule benzénu (6 elektrónov π utvára prstence nad a pod rovinou kruhu) Delokalizačná energia benzénu je vysoká a má hodnotu 151 k. J. mol-1. Rozloženie spolu šiestich elektrónov π v molekule benzénu znázorňuje obr. 20. Dĺžka väzieb medzi dvoma hociktorými susednými uhlíkmi je v molekulách benzénu rovnaká a ich vzdialenosť je 0, 139 nm, čo je menej ako pri väzbe C–C (0, 154 nm) a viac ako pri väzbe C=C (0, 134 nm). H 4 CHÉMIA ZLÚČENÍN UHLÍKA -2 - benzén HNO 3 , H 2 SO 4 O 2 N NO 2 – H 2 O nitrobenzén 1, 3 -dinitrobenzén

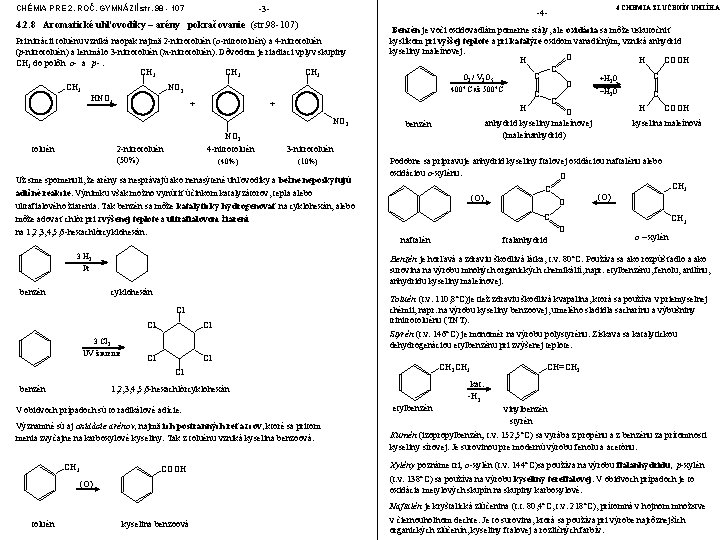
CHÉMIA PRE 2. ROČ. GYMNÁZIÍ str. 98 - 107 -3 - 4. 2. 8 Aromatické uhľovodíky – arény pokračovanie (str. 98 -107) Pri nitrácii toluénu vzniká naopak najmä 2 -nitrotoluén (o-nitrotoluén) a 4 -nitrotoluén (p-nitrotoluén) a len málo 3 -nitrotoluén (m-nitrotoluén). Dôvodom je riadiaci vplyv skupiny CH 3 do polôh o- a p-. CH 3 NO 2 HNO 3 + + NO 2 toluén NO 2 4 -nitrotoluén 2 -nitrotoluén (50%) (40%) Benzén je voči oxidovadlám pomerne stály, ale oxidácia sa môže uskutočniť kyslíkom pri vyššej teplote a pri katalýze oxidom vanadičným; vzniká anhydrid kyseliny maleínovej. O H COOH H C C C O 2 / V 2 O 5 +H 2 O O 400°C až 500°C −H 2 O C C C H COOH H O anhydrid kyseliny maleínovej kyselina maleínová benzén (maleínanhydrid) 3 -nitrotoluén (10%) Už sme spomenuli, že arény sa nesprávajú ako nenasýtené uhľovodíky a bežne neposkytujú adičné reakcie. Výnimku však možno vynútiť účinkom katalyzátorov, tepla alebo ultrafialového žiarenia. Tak benzén sa môže katalyticky hydrogenovať na cyklohexán, alebo môže adovať chlór pri zvýšenej teplote a ultrafialovom žiarení na 1, 2, 3, 4, 5, 6 -hexachlórcyklohexán. 3 H 2 Podobne sa pripravuje anhydrid kyseliny ftalovej oxidáciou naftalénu alebo oxidáciou o-xylénu: O (O) benzén cyklohexán Cl Cl Cl 3 Cl 2 UV žiarenie O (O) C O naftalén ftalanhydrid CH 3 o – xylén Cl Toluén (t. v. 110, 8°C)je tiež zdraviu škodlivá kvapalina, ktorá sa používa v priemyselnej chémii, napr. na výrobu kyseliny benzoovej, umelého sladidla sacharínu a výbušniny trinitrotoluénu (TNT). Styrén (t. v. 146°C) je monomér na výrobu polystyrénu. Získava sa katalytickou dehydrogenáciou etylbenzénu pri zvýšenej teplote. Cl CH 2 CH 3 Cl 1, 2, 3, 4, 5, 6 -hexachlórcyklohexán V obidvoch prípadoch sú to radikálové adície. Významné sú aj oxidácie arénov, najmä ich postranných reťazcov, ktoré sa pritom menia zvyčajne na karboxylové kyseliny. Tak z toluénu vzniká kyselina benzoová. CH 3 C Benzén je horľavá a zdraviu škodlivá látka, t. v. 80°C. Používa sa ako rozpúšťadlo a ako surovina na výrobu mnohých organických chemikálií, napr. etylbenzénu, fenolu, anilínu, anhydridu kyseliny maleínovej. Pt benzén 4 CHÉMIA ZLÚČENÍN UHLÍKA -4 - COOH (O) etylbenzén CH=CH 2 kat. -H 2 vinylbenzén styrén Kumén (izopropylbenzén; t. v. 152, 5°C) sa vyrába z propénu a z benzénu za prítomnosti kyseliny sírovej. Je surovinou pre modernú výrobu fenolu a acetónu. Xylény poznáme tri; o-xylén (t. v. 144°C)sa používa na výrobu ftalanhydridu, p-xylén (t. v. 138°C) sa používa na výrobu kyseliny tereftalovej. V obidvoch prípadoch je to oxidácia metylových skupín na skupiny karboxylové. Naftalén je kryštalická zlúčenina (t. t. 80, 4°C, t. v. 218°C), prítomná v hojnom množstve toluén kyselina benzoová v čiernouhoľnom dechte. Je to surovina, ktorá sa používa pri výrobe najrôznejších organických zlúčenín, kyseliny ftalovej a rozličných farbív.

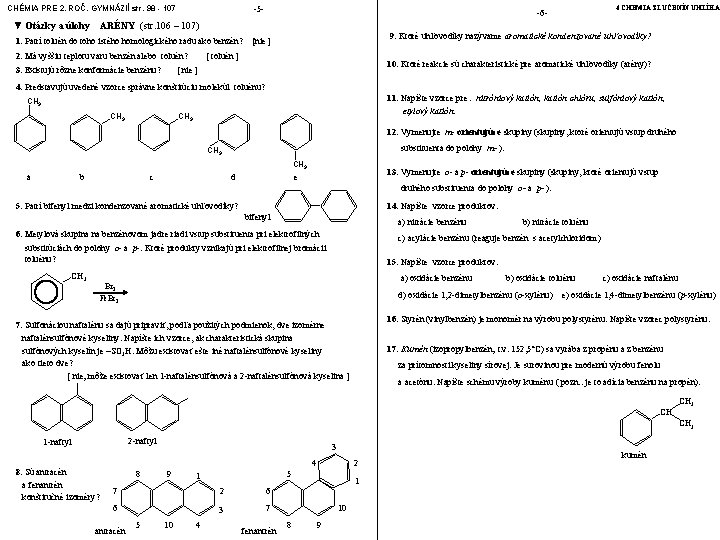
CHÉMIA PRE 2. ROČ. GYMNÁZIÍ str. 98 - 107 ▼ Otázky a úlohy -5 - ARÉNY (str. 106 – 107) 1. Patrí toluén do toho istého homologického radu ako benzén? 4 CHÉMIA ZLÚČENÍN UHLÍKA -6 - 9. Ktoré uhľovodíky nazývame aromatické kondenzované uhľovodíky? [nie ] 2. Má vyššiu teplotu varu benzén alebo toluén? [ toluén ] 3. Existujú rôzne konformácie benzénu? [ nie ] 10. Ktoré reakcie sú charakteristické pre aromatické uhľovodíky (arény)? 4. Predstavujú uvedené vzorce správne konštitúciu molekúl toluénu? 11. Napíšte vzorce pre : nitróniový katión, katión chlóru, sulfóniový katión, etylový katión. CH 3 12. Vymenujte m- orientujúce skupiny (skupiny, ktoré orientujú vstup druhého substituenta do polohy m- ). CH 3 a b c d 13. Vymenujte o- a p- orientujúce skupiny (skupiny, ktoré orientujú vstup e druhého substituenta do polohy o- a p- ). 5. Patrí bifenyl medzi kondenzované aromatické uhľovodíky? 14. Napíšte vzorce produktov: bifenyl a) nitrácie benzénu 6. Metylová skupina na benzénovom jadre riadi vstup substituenta pri elektrofilných c) acylácie benzénu (reaguje benzén s acetylchloridom) substitúciách do polohy o- a p-. Ktoré produkty vznikajú pri elektrofilnej bromácii toluénu? CH 3 b) nitrácie toluénu 15. Napíšte vzorce produktov: a) oxidácie benzénu Br 2 Fe. Br 3 b) oxidácie toluénu d) oxidácie 1, 2 -dimetylbenzénu (o-xylénu) c) oxidácie naftalénu e) oxidácie 1, 4 -dimetylbenzénu (p-xylénu) 16. Styrén (vinylbenzén) je monomér na výrobu polystyrénu. Napíšte vzorec polystyrénu. 7. Sulfonáciou naftalénu sa dajú pripraviť, podľa použitých podmienok, dve izomérne naftalénsulfónové kyseliny. Napíšte ich vzorce, ak charakteristická skupina sulfónových kyselín je –SO 3 H. Môžu existovať ešte iné naftalénsulfónové kyseliny ako tieto dve? [ nie; môže existovať len 1 -naftalénsulfónová a 2 -naftalénsulfónová kyselina ] 17. Kumén (izopropylbenzén; t. v. 152, 5°C) sa vyrába z propénu a z benzénu za prítomnosti kyseliny sírovej. Je surovinou pre modernú výrobu fenolu a acetónu. Napíšte schému výroby kuménu ( pozn. : je to adícia benzénu na propén). CH CH 3 2 -naftyl 1 -naftyl 8. Sú antracén a fenantrén konštitučné izoméry? 3 4 8 9 5 1 7 2 6 6 3 7 antracén 5 10 4 2 fenantrén 1 10 8 9 kumén