1 Autorem materilu a vech jeho st nenli
![[1] Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Věra Pavlátová. Dostupné [1] Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Věra Pavlátová. Dostupné](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-1.jpg)
![KLUCI NERADI UMÝVAJÍ NÁDOBÍ! [2] KLUCI NERADI UMÝVAJÍ NÁDOBÍ! [2]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-3.jpg)
![Vyskytují se ve druhé skupině PSP. [3] Vyskytují se ve druhé skupině PSP. [3]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-4.jpg)
![Mezi kovy alkalických zemin řadíme: vápník, baryum, stroncium a radium. [1] Jsou to Mezi kovy alkalických zemin řadíme: vápník, baryum, stroncium a radium. [1] Jsou to](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-5.jpg)

![Jejich sloučeniny také barví plamen (vápník [5] Ca cihlově červeně, stroncium a radium červeně, Jejich sloučeniny také barví plamen (vápník [5] Ca cihlově červeně, stroncium a radium červeně,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-8.jpg)

![[8] Je to 5. nejrozšířenější prvek v ZK. Vyskytuje se jako: vápenec, kalcit, aragonit, [8] Je to 5. nejrozšířenější prvek v ZK. Vyskytuje se jako: vápenec, kalcit, aragonit,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-10.jpg)
![[15] Chem. složení: Ca. CO 3 Tvrdost: 3, 0 Hustota (od-do): 2, 6– 2, [15] Chem. složení: Ca. CO 3 Tvrdost: 3, 0 Hustota (od-do): 2, 6– 2,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-11.jpg)

![[18] Chem. složení: Ca. F 2 Tvrdost: 4 Hustota (od-do): 3, 1– 3, 2 [18] Chem. složení: Ca. F 2 Tvrdost: 4 Hustota (od-do): 3, 1– 3, 2](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-13.jpg)


![[22] Oxid vápenatý je bílá práškovitá látka. Vyrábí se z vápence pod názvem pálené [22] Oxid vápenatý je bílá práškovitá látka. Vyrábí se z vápence pod názvem pálené](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-18.jpg)



![[28] [25] [27] [28] [25] [27]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-22.jpg)

![[31] Karbid vápenatý Ca. C 2 se používá jako silné redukční činidlo a dříve [31] Karbid vápenatý Ca. C 2 se používá jako silné redukční činidlo a dříve](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-24.jpg)

![[10] [9] V přírodě se vyskytuje jako baryt (těží se i u Teplic). Peroxid [10] [9] V přírodě se vyskytuje jako baryt (těží se i u Teplic). Peroxid](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-27.jpg)
![[32] Chem. složení: Ba. SO 4 Tvrdost (od-do): 3, 0– 3, 5 Hustota: 4, [32] Chem. složení: Ba. SO 4 Tvrdost (od-do): 3, 0– 3, 5 Hustota: 4,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-28.jpg)





![Tomihahndorf. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: Tomihahndorf. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http:](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-35.jpg)
![Davepape. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: Davepape. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http:](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-36.jpg)
![Pearson Scott Foresman. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na Pearson Scott Foresman. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-37.jpg)
- Slides: 37
![1 Autorem materiálu a všech jeho částí neníli uvedeno jinak je Věra Pavlátová Dostupné [1] Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Věra Pavlátová. Dostupné](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-1.jpg)
[1] Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Věra Pavlátová. Dostupné z Metodického portálu www. rvp. cz, ISSN: 1802 -4785, financovaného z ESF a státního rozpočtu ČR. Provozuje Národní ústav pro vzdělávání, školské poradenské zařízení a zařízení pro další vzdělávání pedagogických pracovníků (NÚV).

Autor: Mgr. Věra Pavlátová Anotace: Materiál vychází ze vzdělávací oblasti Člověk a příroda, vzdělávacího oboru Chemie, Anorganická chemie. Žáci se dozvídají informace o s 2 -prvcích. Očekávaný výstup dle ŠVP: Druh učebního materiálu: Žák charakterizuje významné zástupce a jejich sloučeniny, zhodnotí využití v praxi. Cílová skupina: Stupeň a typ vzdělávání: Typická věková skupina: Prezentace, DUM. Je možné ji použít v rámci expozice i fixace, délka aktivity 45 minut. Žák zde naplňuje KK k řešení problémů, k učení, komunikativní, sociální a personální. Gymnaziální vzdělávání 16− 18 let, 6. třída / II. ročník KLIKNĚTE NA F 5 Prezentace je snadno upravitelná dle konkrétního ŠVP.
![KLUCI NERADI UMÝVAJÍ NÁDOBÍ 2 KLUCI NERADI UMÝVAJÍ NÁDOBÍ! [2]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-3.jpg)
KLUCI NERADI UMÝVAJÍ NÁDOBÍ! [2]
![Vyskytují se ve druhé skupině PSP 3 Vyskytují se ve druhé skupině PSP. [3]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-4.jpg)
Vyskytují se ve druhé skupině PSP. [3]
![Mezi kovy alkalických zemin řadíme vápník baryum stroncium a radium 1 Jsou to Mezi kovy alkalických zemin řadíme: vápník, baryum, stroncium a radium. [1] Jsou to](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-5.jpg)
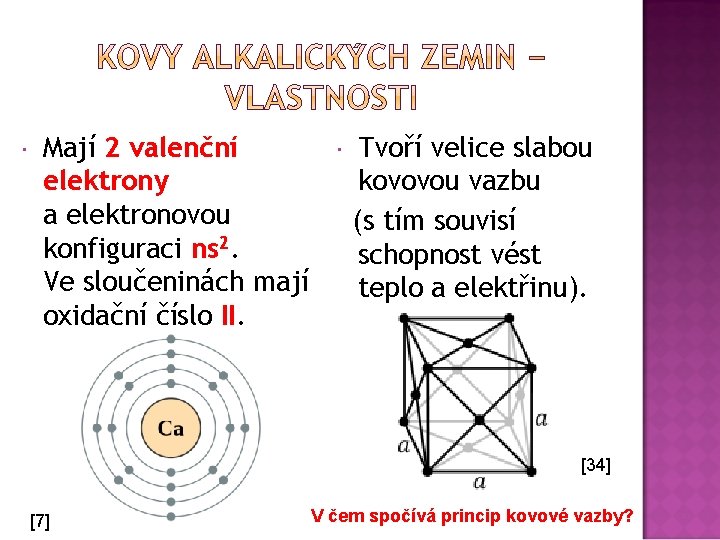
Mezi kovy alkalických zemin řadíme: vápník, baryum, stroncium a radium. [1] Jsou to stříbrolesklé kovy o něco tvrdší a méně reaktivní než alkalické kovy. [10] Baryum

Mají 2 valenční elektrony a elektronovou konfiguraci ns 2. Ve sloučeninách mají oxidační číslo II. Tvoří velice slabou kovovou vazbu (s tím souvisí schopnost vést teplo a elektřinu). [34] [7] V čem spočívá princip kovové vazby?

Také ochotně reagují se složkami vzduchu, proto se uchovávají v kapalinách, jež přístupu vzduchu zabraňují (např. v petroleji). [13] Stroncium
![Jejich sloučeniny také barví plamen vápník 5 Ca cihlově červeně stroncium a radium červeně Jejich sloučeniny také barví plamen (vápník [5] Ca cihlově červeně, stroncium a radium červeně,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-8.jpg)
Jejich sloučeniny také barví plamen (vápník [5] Ca cihlově červeně, stroncium a radium červeně, baryum zeleně). Videa – odkaz: http: //www. physagreg. fr/video. php http: //www. youtube. com/watch? v=k. Pq 6 yk. CCmwk&feature=related (Plamenová zkouška – kovy alkalických zemin – Ca 2+, Sr 2+, Ba 2+, foukány do plamene) Proč dochází k barvení plamene? Energie plamene způsobí přechod částic do excitovaného stavu. Část přijaté energie je pak uvolněna ve formě určitého barevného spektra záření. [5] Sr [6] Ba

Reakcí s kyslíkem vznikají oxidy. 2 Ca + O 2 2 Ca. O S vodou reagují za vzniku hydroxidu a vodíku. Reakce není tak bouřlivá jak u alkalických kovů. Ca + 2 H 2 O Ca(OH)2 + H 2 Reakcí s vodíkem vznikají hydridy. Ca + H 2 Ca. H 2 Reakcí s dusíkem vznikají nitridy. 3 Ca + N 2 Ca 3 N 2
![8 Je to 5 nejrozšířenější prvek v ZK Vyskytuje se jako vápenec kalcit aragonit [8] Je to 5. nejrozšířenější prvek v ZK. Vyskytuje se jako: vápenec, kalcit, aragonit,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-10.jpg)
[8] Je to 5. nejrozšířenější prvek v ZK. Vyskytuje se jako: vápenec, kalcit, aragonit, sádrovec, fluorit, dolomit, fosforit, apatit a plagioklas. Je biogenní; součástí kostí, zubů, svalů, vaječné skořápky u ptáků, ulit a lastur u měkkýšů, schránek korálů. Jeho nedostatek může způsobit křivici nebo osteoporózu. Jeho sloučeniny jsou známé od starověku, v Římě používali „maltu“ z vápence, v Egyptě „maltu“ ze sádrovce (viz. omítky pyramid).
![15 Chem složení Ca CO 3 Tvrdost 3 0 Hustota oddo 2 6 2 [15] Chem. složení: Ca. CO 3 Tvrdost: 3, 0 Hustota (od-do): 2, 6– 2,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-11.jpg)
[15] Chem. složení: Ca. CO 3 Tvrdost: 3, 0 Hustota (od-do): 2, 6– 2, 8 Kryst. soustava: šesterečná, klencová Barva: Lom: Barva vrypu: bílá, šedá Štěpnost miskovitý bílá dokonalá Lesk: skelný až perleťový Vlastnosti a použití: Je to horninotvorný materiál, snadno rozpustný. Má vysoký dvojlom. [16] Rozpustnost kalcitu již v kyselých vodách se projevuje při vzniku krasových jevů.

Chem. složení: Ca. SO 4. 2 H 2 O Tvrdost: 2, 0 Hustota: 2, 32 Kryst. soustava: jednoklonná Barva: Barva vrypu: bílá Lom: Štěpnost tříštivý dokonalá Lesk: Vlastnosti použití: [19] matný až hedvábný Ložiska vznikla a vypařováním mořské vody. Používá se k výrobě sádry. Jemně zrnitý sádrovec se nazývá alabastr a používá se v sochařství.
![18 Chem složení Ca F 2 Tvrdost 4 Hustota oddo 3 1 3 2 [18] Chem. složení: Ca. F 2 Tvrdost: 4 Hustota (od-do): 3, 1– 3, 2](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-13.jpg)
[18] Chem. složení: Ca. F 2 Tvrdost: 4 Hustota (od-do): 3, 1– 3, 2 Kryst. soustava: krychlová Barva: Lom: Barva vrypu: žlutá, zelená, fialová bílá Štěpnost: lasturnatý dokonalá Lesk: skelný Vlastnosti a použití: Fluorit neboli kazivec je surovinou pro výrobu sloučenin fluoru. Také se brousí na drahokamy. [17]

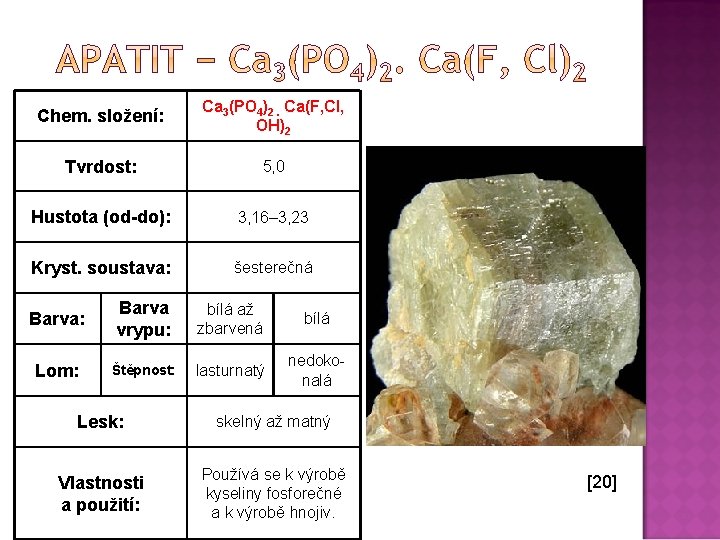
Chem. složení: Ca 3(PO 4)2. Ca(F, Cl, OH)2 Tvrdost: 5, 0 Hustota (od-do): 3, 16– 3, 23 Kryst. soustava: šesterečná Barva: Barva vrypu: bílá až zbarvená bílá Lom: Štěpnost: lasturnatý nedokonalá Lesk: skelný až matný Vlastnosti a použití: Používá se k výrobě kyseliny fosforečné a k výrobě hnojiv. [20]

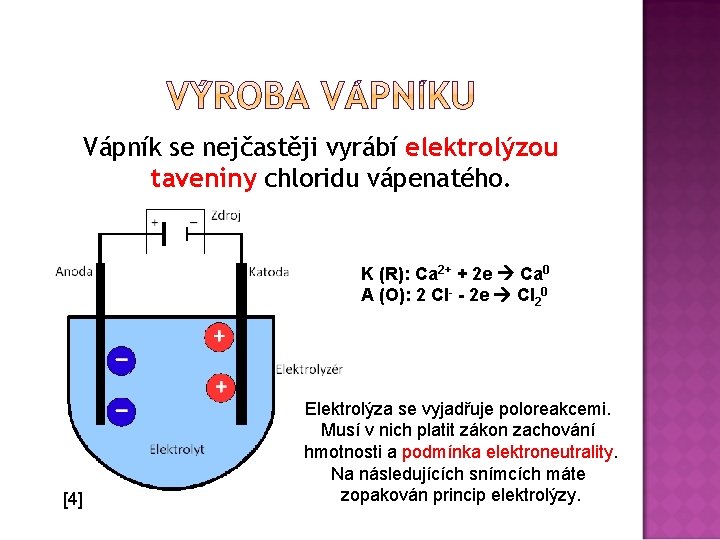
Vápník se nejčastěji vyrábí elektrolýzou taveniny chloridu vápenatého. K (R): Ca 2+ + 2 e Ca 0 A (O): 2 Cl- - 2 e Cl 20 [4] Elektrolýza se vyjadřuje poloreakcemi. Musí v nich platit zákon zachování hmotnosti a podmínka elektroneutrality. Na následujících snímcích máte zopakován princip elektrolýzy.

Je to usměrněný pohyb iontů. Probíhá v roztoku nebo v tavenině. Neprobíhá v pevné látce. Podmínka – připojení ke zdroji stejnosměrného elektrického napětí (jinak by elektrody byly chvíli anodou a chvíli katodou a pohyb iontů by byl neusměrněný). Přenos el. náboje. Přenos hmoty.

A (O): 2 Cl- - 2 e Cl 20 Anoda Katoda kladná elektroda, probíhá na ní oxidace připojena ke kladnému pólu zdroje napětí v elektrickém poli k ní putují záporné ionty – anionty K (R): Ca 2+ + 2 e Ca 0 záporná elektroda, probíhá na ní redukce připojena k zápornému pólu zdroje napětí v elektrickém poli k ní putují kladné ionty ‒ kationty [4]
![22 Oxid vápenatý je bílá práškovitá látka Vyrábí se z vápence pod názvem pálené [22] Oxid vápenatý je bílá práškovitá látka. Vyrábí se z vápence pod názvem pálené](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-18.jpg)
[22] Oxid vápenatý je bílá práškovitá látka. Vyrábí se z vápence pod názvem pálené vápno: Ca. CO 3 → Ca. O + CO 2 Ca. O se využívá ve stavebnictví, ale také se přidává jako E 529 do mouky. [23] [21]

Ca(OH)2 je lehký, bílý, beztvarý prášek, který je téměř nerozpustný ve vodě. Vyrábí se hašením páleného vápna nebo reakcí vápníku s vodou: Ca. O + H 2 O→Ca(OH)2 Vodnému roztoku se říká vápenné mléko. Pozor! Je to dráždivá žíravina! Hašené vápno se používá k přípravě malty (písek + voda + vápno). Její postupné tvrdnutí je způsobeno reakcí s oxidem uhličitým: Ca(OH)2 + CO 2→ Ca. CO 3 + H 2 O [24] Úkol: Proč stěny při tvrdnutí malty vlhnou?

Ca. CO 3 je bílá práškovitá látka. V přírodě se vyskytuje hlavně jako vápenec. Působením vnějších vlivů na vápenec vznikají krasové jevy: Úkol: Jaké znáte druhy krápníků? [16] Ca. CO 3 (s) + H 2 O + CO 2 ↔ Ca(HCO 3)2 (aq) vápenec kyselina uhličitá hydrogenuhličitan vápenatý Úkol: Jmenujte místa výskytu krasových jevů v ČR.

Vzniklý hydrogenuhličitan vápenatý je roztok, který protéká dále do podzemních dutin a tam opět tuhne na vápenec Ca. CO 3 (s) + H 2 O + CO 2 ↔ Ca(HCO 3)2 (aq) (opačná reakce). Tímto způsobem vznikají KRASOVÉ JEVY. [26] A – stalaktit, B – brčko, C, D – stalagmit, E – stalagnát, F – prapor, G – záclonky, J – jezírko, K – krystaly, L – terasa, M – puklina
![28 25 27 [28] [25] [27]](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-22.jpg)
[28] [25] [27]

Sádrovec (dihydrát síranu vápenatého) slouží ke štukatérským pracím a ke zhotovování forem a sádry. [19] [29] Sádrovec – pouštní růže Alabastr se používá v sochařství. [30] Sádrovec – alabastr Výroba sádry: Ca. SO 4. 2 H 20 → Ca. SO 4. ½ H 20 + 3/2 H 2 O
![31 Karbid vápenatý Ca C 2 se používá jako silné redukční činidlo a dříve [31] Karbid vápenatý Ca. C 2 se používá jako silné redukční činidlo a dříve](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-24.jpg)
[31] Karbid vápenatý Ca. C 2 se používá jako silné redukční činidlo a dříve se ho využívalo v hornictví ke svícení (karbidka). Princip svícení: Ca. C 2 + 2 H 2 O → C 2 H 2 + Ca(OH)2 ethyn Úkol: V jaké knížce využili chlapci této reakce k vylekání pana Fajsta?

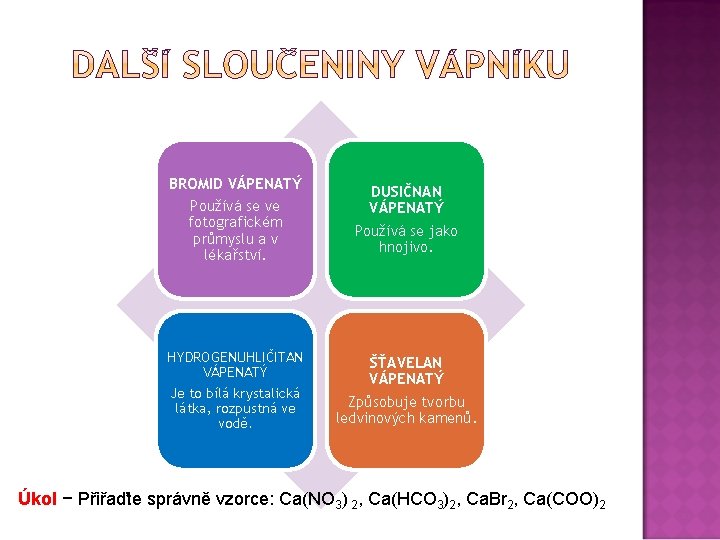
BROMID VÁPENATÝ Používá se ve fotografickém průmyslu a v lékařství. DUSIČNAN VÁPENATÝ Používá se jako hnojivo. HYDROGENUHLIČITAN VÁPENATÝ Je to bílá krystalická látka, rozpustná ve vodě. ŠŤAVELAN VÁPENATÝ Způsobuje tvorbu ledvinových kamenů. Úkol − Přiřaďte správně vzorce: Ca(NO 3) 2, Ca(HCO 3)2, Ca. Br 2, Ca(COO)2

V přírodě se nalézá jako nerost celestin Sr. SO 4 a strontianit Sr. CO 3. [14] [12] Sloučenin stroncia se využívá v pyrotechnice, ve sklářském průmyslu a pro výrobu obrazovek. [13]
![10 9 V přírodě se vyskytuje jako baryt těží se i u Teplic Peroxid [10] [9] V přírodě se vyskytuje jako baryt (těží se i u Teplic). Peroxid](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-27.jpg)
[10] [9] V přírodě se vyskytuje jako baryt (těží se i u Teplic). Peroxid barnatý se používá k bělení hedvábí. Síran barnatý se používá při výrobě kaučuku (elastický polymer). Také se suspenze síranu pije při RTG vyšetření žaludku a střev. Uhličitan se používá ve sklářském a keramickém průmyslu. Sulfid barnatý je jedovatý. Víte, že barnaté soli bývají i v depilačních krémech?
![32 Chem složení Ba SO 4 Tvrdost oddo 3 0 3 5 Hustota 4 [32] Chem. složení: Ba. SO 4 Tvrdost (od-do): 3, 0– 3, 5 Hustota: 4,](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-28.jpg)
[32] Chem. složení: Ba. SO 4 Tvrdost (od-do): 3, 0– 3, 5 Hustota: 4, 5 Kryst. soustava: kosočtverečná Barva: Lom: Barva vrypu: bílá Štěpnost lasturnatý Lesk: Vlastnosti a použití: bílá dokonalá skelný, perleťový Používá se k výrobě barviv, v keramice. Je to zdroj barya. Sloučeniny barya se používají i v zábavné pyrotechnice, barví plamen zelenožlutě.

Je to radioaktivní prvek, z s 2 -prvků nejvíce reaktivní. Bylo objeveno r. 1898 Marií Curie. Sklodowskou v nerostu smolinci z Jáchymova. Může se přeměnit na radon a produkty této přeměny jsou rakovinotvorné. [11] [33] M. Curie

Smaragd Magnezit Dolomit Kalcit Sádrovec Fluorit Apatit Celestin Baryt Sr. SO 4 Mg. CO 3 Ca. F 2 Ba. SO 4 Mg. CO 3. Ca. CO 3 Be 3 Al 2(Si. O 3)6 Ca. CO 3 Ca. SO 4. 2 H 20 Ca 3(PO 4)2. Ca(F, Cl)2

Popište společné vlastnosti s 2 -prvků. Které oxidační číslo je typické pro sloučeniny s 2 -prvků? Které prvky řadíme mezi kovy alkalických zemin? Jak kovy alkalických zemin barví plamen? Zakreslete a zapište výrobu vápníku elektrolýzou. U vybraného s 2 -prvku udejte: výskyt, vlastnosti, použití, výčet sloučenin a jejich význam.

Baryum Vápník Alabastr Pálené vápno Stalaktit Stroncium Peroxid barnatý Radium Krasový jev Bělení hedvábí Výroba obrazovek Barví plamen zeleně Marie Curie Sochařství Výskyt v apatitu Stavebnictví

KLIKEJTE NA VYBRANÁ ČÍSLA ŘEŠENÍCa. F 2 FLUORIT 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20

MAREČEK, A. ; HONZA, J. Chemie pro čtyřletá gymnázia, 1. díl. Nakladatelství Olomouc : 1998. ISBN 8071820555. ŠVECOVÁ, M. ; MATĚJKA, D. Přírodopis 9 učebnice pro základní školy a víceletá gymnázia. 1. vyd. Plzeň : Fraus, 2007. ISBN 9788072385874. Tomihahndorf. [cit. 2011 -09 -14]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Erdalkali. jpg? uselang=cs> 1. Daniel Mayer. [cit. 2011 -09 -14]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Ra-Table. Image. png> 2. Cepheus. [cit. 2011 -09 -14]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Periodic_table_fi. svg> 3. Tomas 1889. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Elektrol%C 3%BDza. jpeg> 4. [cit. 2011 -11 -08]. < http: //www. physagreg. fr/video. php > 5. (Obrázky a videa Physagreg jsou uvolněny veřejnosti, viz. sekce chemie) [cit. 2011 -11 -08]. < http: //www. physagreg. fr/video. php> Pumbaa. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Electron_shell_020_Calcium. svg> 7. 6.
![Tomihahndorf cit 2011 09 17 Dostupný pod licencí Creative Commons na WWW http Tomihahndorf. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http:](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-35.jpg)
Tomihahndorf. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Calcium_1. jpg> 8. Pumbaa. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Electron_shell_056_Barium. svg> 9. Matthias Zepper. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Barium_unter_Argon_Schutzgas_Atmosph %C 3%A 4 re. jpg> 10 Pumbaa. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Electron_shell_088_Radium. svg>11. Matthias Zepper. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Strontium_unter_Argon_Schutzgas_Atmo sph%C 3%A 4 re. jpg> 12. Tomihahndorf. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Strontium_1. jpg> 13. Pumbaa. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Electron_shell_038_Strontium. svg> 14. Rob Lavinsky. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Babingtonite-Calcite-Heulandite-Ca 282525. jpg> 15.
![Davepape cit 2011 09 17 Dostupný pod licencí Public domain na WWW http Davepape. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http:](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-36.jpg)
Davepape. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Stalactites_-_Treak_Cliff_Cavern. jpg> 16. Rob Lavinsky. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Fluorite-278382. jpg> 17. Karelj. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Fluorit_1. jpg> 18. Rob Lavinsky. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Gypsum-tn 15 a. jpg? uselang=cs> 19. Rob Lavinsky. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Apatite-(Ca. F)-Calcite-290700. jpg> 20. Ondřej Mangl. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Oxid_v%C 3%A 1 penat%C 3%BD. PNG> 21. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Calcium-oxide-3 D-vd. W. png> 22. Mk 2010. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Desiccant. JPG> 23. So Leblanc. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Chaux_hydraulique_naturelle_et_eau. JP G> 24.
![Pearson Scott Foresman cit 2011 09 17 Dostupný pod licencí Public domain na Pearson Scott Foresman. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na](https://slidetodoc.com/presentation_image_h/9419eb4f09e6e393b080a7afec845357/image-37.jpg)
Pearson Scott Foresman. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Stalactite_(PSF). svg> 25. chris. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Tropfsteine-hell. svg> 26. krasové jevy Roman Klementschitz. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Katerloch 1. JPG> 27. krápníky Dave Bunnell. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Lechuguilla_Cave_Pearlsian_Gulf. jpg> 28. Rama. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Sand_Rose_1. jpg> 29. sádrovec [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Ankhnesmeryre. II-and-Son-Pepi. IISide. View_Brooklyn. Museum. png> 30. alabastr SCEhardt. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Carbide_lamp_lit. jpg> 31. Rob Lavinsky. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Baryte-275054. jpg> 32. [cit. 2011 -09 -17]. Dostupný pod licencí Public domain na WWW: <http: //commons. wikimedia. org/wiki/File: Marie_Curie_1903. jpg> Stannered. [cit. 2011 -09 -17]. Dostupný pod licencí Creative Commons na WWW: <http: //commons. wikimedia. org/wiki/File: Cubic-face-centered. svg> 34. 33.
 Ikonodulství
Ikonodulství Petr vech
Petr vech Petr vech
Petr vech Petr vech
Petr vech Autorem pisma świętego
Autorem pisma świętego Kto jest autorem
Kto jest autorem Praotec čech a jeho dcery
Praotec čech a jeho dcery Subštandardná forma jazyka
Subštandardná forma jazyka Zvuk a jeho vlastnosti
Zvuk a jeho vlastnosti úhel a jeho velikost
úhel a jeho velikost Sherlock holmes a jeho pomocník
Sherlock holmes a jeho pomocník Bicykel sklonovanie
Bicykel sklonovanie Mussolini a jeho čiernoodenci
Mussolini a jeho čiernoodenci Pověst o svatoplukovi a jeho synech
Pověst o svatoplukovi a jeho synech Karel iv a jeho ženy
Karel iv a jeho ženy Jozef a jeho bratia
Jozef a jeho bratia