1 4 Gemische und Trennverfahren Ein Gemisch besteht

1. 4 Gemische und Trennverfahren Ein Gemisch besteht aus mindestens zwei reinen Stoffen. Gemische können in ihre Bestandteile (reine Stoffe) zerlegt werden.

Homogenes/Heterogenes Gemisch Man unterscheidet zwei Arten von Gemischen: • Homogenes Gemisch: Stoffgemische, bei denen man trotz Vergrösserung mit dem Mikroskop keine einzelnen Bestandteile erkennen kann, nennt man homogen. • Heterogenes Gemisch: Stoffgemische, die nicht einheitlich aufgebaut sind und in denen deshalb die verschiedenen Bestandteile zu erkennen sind, nennt man heterogen.

Beispiele • Salzwasser homogenes Gemisch • Milch heterogenes Gemisch • Luft homogenes Gemisch • Rauch heterogenes Gemisch

Phasen Einen homogenen Bereich eines Stoffes nennt man Phase. Heterogene Stoffgemische bestehen aus mehreren Phasen, zwischen denen es erkennbare Grenzflächen gibt. Bsp. Öl-Wasser-Gemisch

Heterogene Gemische

Gemenge Ein Gemenge ist ein heterogenes Gemisch, welches aus verschiedenen Feststoffen besteht. Beispiel: Granit

Granit ist ein Gemenge aus Feldspat, Quarz und Glimmer.

Suspension (Aufschlämmung) Eine Suspension entsteht, wenn ein Feststoff in einer Flüssigkeit, in der er nicht löslich ist, fein verteilt wird. Beispiele: - Apfelsaft - Orangensaft - aufgewühlter Fluss

Emulsionen entstehen, wenn eine Flüssigkeit in feinen Tropfen in einer anderen Flüssigkeit verteilt wird. Beispiele: - Milch (Fetttröpfchen in Wasser) - Kosmetikprodukte

Schaum In einem Schaum befinden sich Gasblasen in einer Flüssigkeit. Badeschaum Meeresschaum

Nebel In einem Nebel schweben feinste Flüssigkeitstropfen in einem Gas.

Rauch Ein Gemisch aus feinen Feststoffpartikel in einem Gas nennt man Rauch. Zigarettenrauch Rauch über einem Feuer
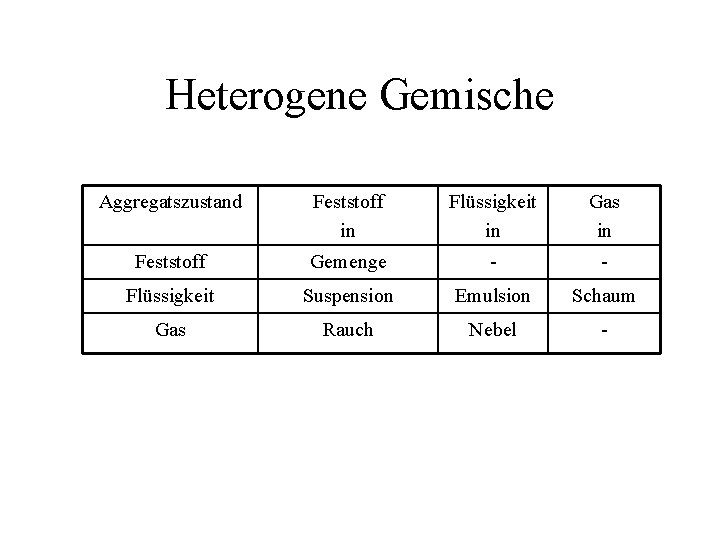
Heterogene Gemische Aggregatszustand Feststoff in Flüssigkeit in Gas in Feststoff Gemenge - - Flüssigkeit Suspension Emulsion Schaum Gas Rauch Nebel -

Homogene Gemische

Legierung Eine Legierung ist ein homogenes Gemisch aus mindestens zwei Metallen (Metalle sind Feststoffe). Bronze ist eine Legierung mit mindestens 60 % Kuper

Lösungen Es gibt verschiedene Arten von Lösungen: Festkörper in Flüssigkeit: z. B. Salzwasser-Lösung Flüssigkeit in Flüssigkeit: z. B. Wasser-Alkohol Gemisch Gas in Flüssigkeit: z. B. Sauerstoff in Wasser Kohlenstoffdioxid in Wasser

Gasgemisch Verschiedene Gase bilden zusammen ein homogenes Gemisch. Man nennt es Gasgemisch. Beispiel: Luft
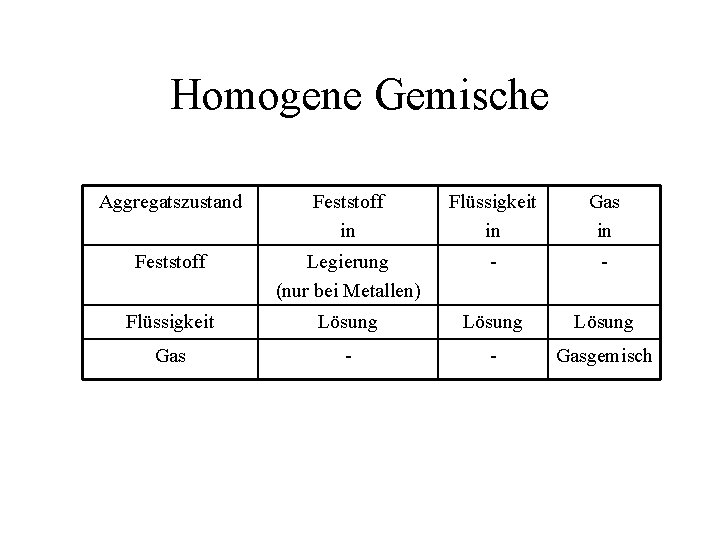
Homogene Gemische Aggregatszustand Feststoff in Flüssigkeit in Gas in Feststoff Legierung (nur bei Metallen) - - Flüssigkeit Lösung Gas - - Gasgemisch

Trennverfahren Mit Hilfe geeigneter Trennverfahren lassen sich Gemische in ihre Bestandteile (reine Stoffe) zerlegen.

Filtration Die Filtration eignet sich zur Trennung von nicht löslichen Feststoffen aus Flüssigkeiten oder Gasen. Ein Filter wirkt wie ein Sieb mit ganz feinen Poren, wodurch der Feststoff zurückgehalten wird. Beispiele: - Teebeutel - Kaffeefilter - Zigarettenfilter Geeignet zur Trennung von: - Suspension - Rauch

Extraktion (Herauslösen) Bei der Extraktion nützt man die unterschiedlichen Löslichkeiten von Feststoffen aus. Mit geeigneten Flüssigkeiten lassen sich einzelne Feststoffe aus einem Gemenge extrahieren (herauslösen), während die unlöslichen Bestandteile zurückbleiben. Beispiele: - Tee - Kaffee Geeignet zur Trennung von: - Gemengen

Trennung mit Scheidetrichter Zwei nicht mischbare Flüssigkeiten können mit Hilfe eines Scheidetrichters getrennt werden. Dabei macht man sich die unterschiedlichen Dichten zu Nutze.

Beispiel: Trennung Wasser und Öl Öl hat eine geringere Dichte als Wasser und befindet sich deshalb in der oberen Phase. Mit Hilfe des Scheidetrichters kann das Wasser nun bis zur Phasengrenze herausgelassen werden.

Zentrifugieren Beim Zentrifugieren wird ein Gemisch schnellen kreisförmigen Bewegungen ausgesetzt. Die Trennung erfolgt aufgrund der unterschiedlichen Dichten durch die Zentrifugalkraft. Geeignet zur Trennung von: - Emulsionen - Suspensionen

Zentrifugieren Blut vor (rechts) und nach (links) dem Zentrifugieren Zentrifuge

Destillation Die Destillation eignet sich zur Trennung von Lösungen aufgrund unterschiedlicher Siedepunkte. Dabei wird eine Lösung so weit erwärmt, dass nur ein reiner Stoff den Siedepunkt erreicht. Die restlichen Stoffe bleiben zurück. Auch Gasgemische können getrennt werden, indem das Gasgemisch zuerst verflüssigt wird (tiefe Temperaturen nötig) und anschliessend eine Destillation durchgeführt wird. Geeignet zur Trennung von: - Lösungen - Gasgemische
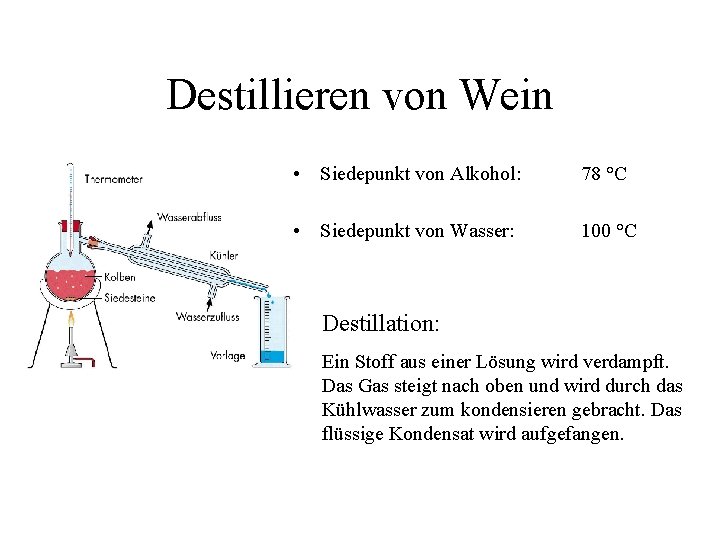
Destillieren von Wein • Siedepunkt von Alkohol: 78 °C • Siedepunkt von Wasser: 100 °C Destillation: Ein Stoff aus einer Lösung wird verdampft. Das Gas steigt nach oben und wird durch das Kühlwasser zum kondensieren gebracht. Das flüssige Kondensat wird aufgefangen.

Weiteres Beispiel: Destilliertes Wasser Um sauberes Wasser aus verunreinigtem Wasser zu gewinnen kann ebenfallf eine Destillation durchgeführt werden. Dieses saubere Wasser nennt man destilliertes Wasser.

Chromatografie Bei der Chromatografie nützt man die unterschiedliche Haftfähigkeit von Feststoffen aus. Bei der Papierchromatographie werden die unterschiedlichen Farbstoffe durch das Fliessmittel unterschiedlich weit befördert. Geeignet zur Trennung von: - Gemenge - Lösung

Trennverfahren zur Trennung genutzte Eigenschaft Geeignet zur Trennung von Filtration Teilchengrösse Suspension, Rauch Extraktion Löslichkeit Gemenge Zentrifugieren Dichte Suspension, Emulsion Destillation Siedetemperatur Lösungen, Gasgemisch Chromatographie Haftfähigkeit Gemenge, Lösungen

Quellenangabe Folie 7: http: //www. kristallin. de/Schweden/Sorsele-Granit. htm Folie 10: http: //adebunklife. blogspot. ch/2011_04_01_archive. html http: //view. stern. de/de/picture/Meeresschaum-Blau-Natur--Landschaft-2256884. html Folie 11: http: //www. rudolf-jetter. de/gedichteordner/nebel. htm Folie 12: http: //de. 123 rf. com/photo_6219769_frau-ausatmen-zigarettenrauch-auf-schwarzem-hintergrund. html http: //www. bahnbilder. de/name/einzelbild/number/484193/kategorie/oesterreich~bahnhoefe~ried-im-innkreis. html Folie 15: http: //bern-1914. org/souvenir/me 05_bronze_medaille. html Folie 25: http: //www. simplyscience. ch/desktopdefault. aspx/tabid-385/41_read-5589 http: //www. mikrooek. de/presse/bildergalerie Folie 27: http: //www. chemiedidaktik. uni-wuppertal. de/alte_seite_du/material/virtklas/Projekt_1_Stromleitung_in_Wasser/
- Slides: 31