1 2 Quale sperimentazione Individuare e gestire correttamente































































- Slides: 66

1

2

Quale sperimentazione. Individuare e gestire correttamente le diverse tipologie Gli studi profit - Gli studi no profit - Gli studi osservazionali Dott. Tiziano Gamba - componente CEI Ospedale Bolognini Seriate 16 – 12 - 2010 3

Normativa di riferimento Aifa circolare 31 -05 -2010 Decreto Ministeriale 14 Luglio 2009 Determinazione AIFA 20 marzo 2008 Decreto Ministeriale 21 dicembre 2007 Decreto Legislativo n. 200 del 6 novembre 2007 Decreto Ministeriale 12 maggio 2006 Decreto Ministeriale 17 dicembre 2004 Decreto Legislativo n. 211 del 24 giugno 2003 Decreto Ministeriale 8 maggio 2003 Circolare Ministeriale n. 6 del 2 settembre 2002 Decreto del Presidente dell'Istituto Superiore di Sanità del 26 aprile 2002 Decreto del Presidente della Repubblica n. 439 del 21 settembre 2001 Decreto Ministeriale del 30 maggio 2001 Decreto Ministeriale del 10 maggio 2001 Circolare Ministeriale n. 15 del 5 ottobre 2000 Decreto Ministeriale del 28 dicembre 2000 Decreto Dirigenziale del 25 maggio 2000 Decreto Ministeriale del 23 novembre 1999 Circolare Ministeriale n. 16 del 12 ottobre 1999 Decreto Ministeriale del 13 maggio 1999 Circolare Ministeriale n. 6 del 8 aprile 1999 Decreto Ministeriale del 20 gennaio 1999 Decreto Ministeriale del 7 ottobre 1998 Decreto Ministeriale del 15 settembre 1998 Decreto Ministeriale del 18 marzo 1998 Decreto Ministeriale del 19 marzo 1998 Decreto Ministeriale del 22 dicembre 1997 Decreto Ministeriale del 15 luglio 1997 ICH Harmonised Tripartite Guideline, 24 June 1993 FDA, Guidance for Institutional Review Boards, Clinical Investigators and Sponsors ICH Harmonised Tripartite Guideline, December 2000 Declaration of Helsinki 4

Che cosa è la sperimentazione clinica “ogni forma di esperimento pianificato su pazienti, programmato per valutare il trattamento più appropriato di futuri pazienti con una determinata condizione patologica” 5

D. L. 24 -06 -2003 SPERIMENTAZIONE CLINICA Il decreto legislativo 211/03 del 24 -06 -2003 definisce distingue le sperimentazioni in: a) sperimentazione clinica: qualsiasi studio sull'uomo finalizzato a scoprire o verificare gli effetti clinici, farmacologici e/o altri effetti farmacodinamici di uno o piu' medicinali sperimentali, e/o a individuare qualsiasi reazione avversa ad uno a piu' medicinali sperimentali, e/o a studiarne l'assorbimento, la distribuzione, il metabolismo e l'eliminazione, con l'obiettivo di accertarne la sicurezza e/o l'efficacia. Questa definizione include le sperimentazioni cliniche effettuate in un unico centro o in piu' centri, solo in Italia o anche in altri Stati membri dell'Unione europea; b) sperimentazione clinica multicentrica: la sperimentazione clinica effettuata in base ad un unico protocollo in piu' di un centro e che pertanto viene eseguita da piu' sperimentatori; i centri in cui si effettua la sperimentazione possono essere ubicati solo in Italia, oppure anche in altri Stati dell'Unione europea e/o Paesi terzi; c) sperimentazione non interventistica (studio osservazionale): uno studio nel quale i medicinali sono prescritti secondo le indicazioni dell'autorizzazione all'immissione in commercio. L'assegnazione del paziente a una determinata strategia terapeutica non e' decisa in anticipo da un protocollo di sperimentazione, ma rientra nella normale pratica clinica e la decisione di prescrivere il medicinale e' del tutto indipendente da quella di includere il paziente nello studio. Ai pazienti non si applica nessuna procedura supplementare di diagnosi o monitoraggio, e per l'analisi dei dati raccolti sono utilizzati metodi epidemiologici; 6

DL 24 -06 -2003 Poi il DL continua definendo che cosa si intende per: d) medicinale sperimentale: una forma farmaceutica di un principio attivo o di un placebo saggiato come medicinale sperimentale o come controllo in una sperimentazione clinica compresi i prodotti che hanno gia' ottenuto un'autorizzazione di commercializzazione ma che sono utilizzati o preparati (secondo formula magistrale o confezionati) in forme diverse da quella autorizzata, o quando sono utilizzati per indicazioni non autorizzate o per ottenere ulteriori informazioni sulla forma autorizzata; e) promotori della sperimentazione: una persona, societa', istituzione oppure un organismo che si assume la responsabilita' di avviare, gestire e/o finanziare una sperimentazione clinica; f) sperimentatore: un medico o un odontoiatra qualificato ai fini delle sperimentazioni, responsabile dell'esecuzione della sperimentazione clinica in un dato centro. Se la sperimentazione e' svolta da un gruppo di persone nello stesso centro, lo sperimentatore responsabile del gruppo e' definito sperimentatore principale; g) dossier per lo sperimentatore: la raccolta di dati clinici e non clinici sul medicinale o sui medicinali in fase di sperimentazione che sono pertinenti per lo studio dei medesimi nell'uomo; h) protocollo: il documento in cui vengono descritti l'obiettivo o gli obiettivi, la progettazione, la metodologia, gli aspetti statistici e l'organizzazione della sperimentazione, il termine protocollo comprende il protocollo, le versioni successive e le modifiche dello stesso 7

D. L. 24 -06 -2003 i) soggetto: la persona che partecipa a una sperimentazione clinica, sia come destinataria del medicinale in sperimentazione sia come controllo; l) consenso informato: la decisione di un soggetto candidato ad essere incluso in una sperimentazione, scritta, datata e firmata, presa spontaneamente, dopo esaustiva informazione circa la natura, il significato, le conseguenze ed i rischi della sperimentazione e dopo aver ricevuto la relativa documentazione appropriata. La decisione e' espressa da un soggetto capace di dare il consenso, ovvero, qualora si tratti di una persona che non e' in grado di farlo, dal suo rappresentante legale o da un'autorita', persona o organismo nel rispetto delle disposizioni normative vigenti in materia. Se il soggetto non e' in grado di scrivere, puo' in via eccezionale fornire un consenso orale alla presenza di almeno un testimone, nel rispetto della normativa vigente; m) comitato etico: un organismo indipendente, composto da personale sanitario e non, che ha la responsabilita' di garantire la tutela dei diritti, della sicurezza e del benessere dei soggetti in sperimentazione e di fornire pubblica garanzia di tale tutela, esprimendo, ad esempio, un parere sul protocollo di sperimentazione, sull'idoneita' degli sperimentatori, sulla adeguatezza delle strutture e sui metodi e documenti che verranno impiegati per informare i soggetti e per ottenerne il consenso informato; 8

D. L. 24 -06 -2003 n) ispezione: svolgimento da parte del Ministero della salute e/o di autorita' regolatorie di altri Stati di un controllo ufficiale dei documenti, delle strutture, delle registrazioni, dei sistemi per la garanzia di qualita' e di qualsiasi altra risorsa che le predette autorita' giudicano pertinenti. L'ispezione puo' svolgersi presso il centro di sperimentazione, presso le strutture del promotore della sperimentazione e/o presso le strutture di organizzazioni di ricerca a contratto, oppure in altri luoghi ritenuti appropriati da tali Autorita'; o) evento avverso: qualsiasi evento clinico dannoso che si manifesta in un paziente o in un soggetto coinvolto in un sperimentazione clinica cui e' stato somministrato un medicinale, e che non ha necessariamente un rapporto causale con questo trattamento; p) reazione avversa: qualsiasi reazione dannosa e indesiderata a un medicinale in fase di sperimentazione, a prescindere dalla dose somministrata; q) evento avverso serio o reazione avversa seria: qualsiasi evento avverso o reazione avversa che, a prescindere dalla dose, ha esito nella morte o mette in pericolo la vita del soggetto, richiede un ricovero ospedaliero o prolunga una degenza in ospedale, o che determina invalidita' o incapacita' gravi o prolungate, o comporta un'anomalia congenita o un difetto alla nascita; r) reazione avversa inattesa: una reazione avversa di natura o gravita' non prevedibili in base alle informazioni relative al prodotto (per esempio a quelle riportate nel dossier per lo sperimentatore se il prodotto e' in sperimentazione o, nel caso di un prodotto autorizzato, nella scheda delle caratteristiche del prodotto); s) centro collaboratore: centro, ove non opera lo sperimentatore coordinatore, che partecipa ad una sperimentazione multicentrica; 9

D. L. 24 -06 -2003 Art. 3. Tutela dei soggetti della sperimentazione clinica Art. 4. Sperimentazione clinica sui minori Art. 5. Sperimentazione clinica su adulti incapaci di dare validamente il proprio consenso informato Art. 6. Comitato etico Art. 7 Parere unico 10

Art. 3. Tutela dei soggetti della sperimentazione clinica D. L. 24 -06 -2003 La sperimentazione clinica puo' essere intrapresa esclusivamente a condizione che: a) i rischi e gli inconvenienti prevedibili siano stati soppesati rispetto al vantaggio per il soggetto incluso nella sperimentazione… b) il soggetto che partecipa alla sperimentazione …. abbia avuto la il soggetto possibilita… di comprendere gli obiettivi, i rischi e gli inconvenienti della comprendere gli obiettivi sperimentazione… c) sia rispettato il diritto all'integrita' fisica e mentale… d) il soggetto che partecipa alla sperimentazione… abbia dato il suo consenso e) il soggetto… possa rinunciare a partecipare alla sperimentazione clinica in qualsiasi momento… f) il promotore della sperimentazione provvede alla copertura assicurativa… 11

Art. 4. Sperimentazione clinica sui minori D. L. 24 -06 -2003 In aggiunta a tutte le altre prescrizioni … a) sia stato ottenuto il consenso informato dei genitori. . il consenso informato dei genitori deve comunque rispecchiare la volonta' del minore b) il minore abbia ricevuto informazioni commisurate alla sua capacita' di comprensione c) lo sperimentatore… tenga in considerazione la volonta' esplicita del minore … d) …solo se la ricerca e' essenziale per convalidare dati ottenuti in se la ricerca e' essenziale sperimentazioni… f) le sperimentazioni cliniche siano state concepite in modo da ridurre al minimo il dolore, il disagio, la paura e ogni altro rischio prevedibile g) il protocollo sia stato approvato da un comitato etico con competenza anche pediatrica… h) l'interesse del paziente prevalga sempre sugli interessi della l'interesse del paziente prevalga scienza e della societa'. 12

D. L. 24 -06 -2003 Art. 5. Sperimentazione clinica su adulti incapaci di dare validamente il proprio consenso informato Praticamente sovrapponibile nella sostanza al precedente ( ndr) 13

Art. 6. Comitato etico D. L. 24 -06 -2003 1. Il comitato etico deve emettere il proprio parere prima dell'inizio di qualsiasi sperimentazione clinica in merito alla quale dell'inizio e' stato interpellato. 3. . . Il comitato etico nel caso di sperimentazioni monocentriche, entro sessanta giorni… comunica …il proprio parere motivato. Nel caso entro sessanta giorni di sperimentazioni multicentriche si applica quanto disposto dall'articolo 7. 4. Il comitato etico, durante il periodo di esame … puo' una sola volta chiedere di acquisire informazioni integrative… in questo caso il termine integrative e‘ sospeso fino all'acquisizione delle informazioni di cui sopra. e‘ sospeso. 14

Art. 7 Parere unico D. L. 24 -06 -2003 1. Nel caso di sperimentazioni cliniche multicentriche …il parere motivato sulla sperimentazione stessa e' espresso dal comitato etico della struttura italiana alla quale afferisce lo sperimentatore etico coordinatore per l'Italia, entro trenta giorni … coordinatore 2. I comitati etici interessati dalla sperimentazione possono comunicare al comitato etico di cui al comma 1, eventuali comunicare osservazioni… osservazioni 3. Il parere favorevole puo' essere solo accettato ovvero rifiutato nel suo complesso dai comitati etici degli altri centri italiani nel suo complesso partecipanti alla sperimentazione stessa; i comitati etici di tutti i centri in cui e' effettuata la sperimentazione possono modificare la formulazione del consenso informato … L'accettazione o il rifiuto… adeguatamente motivati, debbono essere comunicati dai comitati dei centri collaboratori al promotore …entro un massimo di 30 giorni 15

D. L. 24 -06 -2003 Tutti i successivi articoli sono stati poi regolamentati dal DM 21 -12 -2007) - 4 anni dopo Art. 8. Modalita' di presentazione della domanda per il parere del comitato etico Art. 9. Inizio di una sperimentazione clinica Art. 10. Conduzione di una sperimentazione clinica Art. 11. Scambio di informazioni Art. 12. Sospensione della sperimentazione o infrazioni Art. 13. Fabbricazione e importazione di medicinali in fase di sperimentazione Art. 14. Etichettatura 16

D. L. 24 -06 -2003 Art. 15. Verifica dell'osservanza delle norme di buona pratica clinica e di fabbricazione dei medicinali in fase di sperimentazione Art. 16. Notifica di eventi avversi Art. 17. Notifica delle reazioni avverse serie Art. 18. Indicazioni relative alle relazioni Art. 19. Obbligo di trasmissione di informazioni Art. 20. Disposizioni a carattere generale Art. 21. Norme transitorie Art. 22. Apparato sanzionatorio 17

18

19

Lascio volentieri ad altri colleghi ed alla segreteria l’arduo compito della descrizione della complessa modulistica e delle formalità di presentazione delle richieste di autorizzazione o delle notifiche 20

I principi per affrontare una sperimentazione clinica metodologicamente corretta sono stati formalizzati in una serie di norme di PIANIFICAZIONE e di CONDUZIONE che rendono scientificamente valida la sperimentazione stessa 21

I principi per affrontare una sperimentazione clinica metodologicamente corretta sono stati formalizzati in una serie di norme di PIANIFICAZIONE e di CONDUZIONE che rendono scientificamente valida la sperimentazione stessa 22

Il protocollo di studio è il documento formale in cui: • si descrivono rigorosamente il razionale della ricerca, gli obiettivi specifici, il disegno dello studio e la metodologia di esecuzione • si fissano le linee guida di comportamento alla luce dei risvolti etici della sperimentazione 23

Il percorso operativo Definizione degli obiettivi della ricerca Pianificazione della ricerca Conduzione della ricerca Analisi dei dati Elaborazione delle conclusioni 24

Obiettivo della ricerca La definizione degli obiettivi della ricerca presuppone la fissazione di una ipotesi di lavoro in cui siano contenuti gli elementi base della ricerca stessa, quindi: • La definizione del trattamento • La scelta degli End Points • Il gruppo di controllo e relativo trattamento • La scelta dei pazienti 25

Il trattamento La definizione del trattamento implica la definizione di un preciso schema di somministrazione relativamente a : • POSOLOGIA • EVENTUALI MODIFICHE DEL DOSAGGIO • DURATA DELLA SOMMINISTRAZIONE 26

End Points Gli End Points sono le “variabili di risposta”, ossia le misurazioni fatte per rispondere ai quesiti della sperimentazione. Ad ogni quesito corrisponde un End Point specifico. 27

Il gruppo di controllo • E’ un gruppo di pazienti che deve possedere, nei limiti della variabile casuale, tutti i requisiti del gruppo trattato tranne il trattamento in studio • Il gruppo di controllo serve a valutare se il trattamento con il farmaco è in grado o meno di produrre benefici terapeutici • Al gruppo di controllo è assegnata la base di riferimento 28

Il trattamento di controllo Il gruppo di controllo può essere trattato con: • PLACEBO • TRATTAMENTO STANDARD • NESSUN TRATTAMENTO 29

Scopi del confronto trattamenti • Confronto vs Placebo : misura il puro effetto farmacologico • Confronto vs trattamento standard fornisce la stima quantitativa e qualitativa dell’efficacia del farmaco e la sua reale importanza terapeutica 30

La scelta dei pazienti deve essere : • IDONEA AD ESPLORARE LE IPOTESI DI RICERCA • OMOGENEA • NUMERICAMENTE ADEGUATA PER FORNIRE UN CAMPIONE STATISTICAMENTE SIGNIFICATIVO 31

La Pianificazione della Ricerca Pianificare al meglio la ricerca significa scegliere un disegno sperimentale che applichi tecniche (es randomizzazione e cecità) che servono ad eliminare / ridurre gli elementi di giudizio soggettivi e/o influenze esterne in grado di alterare, positivamente o negativamente, i risultati. 32

Pianificazione della Ricerca • RANDOMIZZAZIONE : l’assegnazione dei trattamento a confronto viene fatta casualmente sui soggetti arruolati • CECITA’ : l’assegnazione dei trattamenti viene fatta senza che ci sia conoscenza da parte del soggetto (singola) o del soggetto e dello sperimentatore (doppia) di quale trattamento sia stato assegnato 33

La conduzione della ricerca Anche nella conduzione della ricerca vanno perseguiti alcuni principi metodologici: • Reclutamento dei pazienti che garantisca la rappresentatività del campione • Accuratezza e precisione nella raccolta dei dati • Scelta adeguata dei centri che dovranno condurre la sperimentazione 34

Analisi dei risultati L’analisi dei risultati viene fatta con il supporto dell’analisi statistica che deve : • Fornire una visione globale e di dettaglio dei risultati • Valutare la significatività statistica, ossia fornire la certezza che i risultati della ricerca siano estensibili ad una popolazione più vasta che non il campione, eliminando la possibilità che essi siano dovuti al caso 35

Le conclusioni dello studio sono riassunte in un rapporto di ricerca che evidenzia: • • Le motivazioni della ricerca La metodologia usata I risultati ottenuti La discussione dei risultati 36

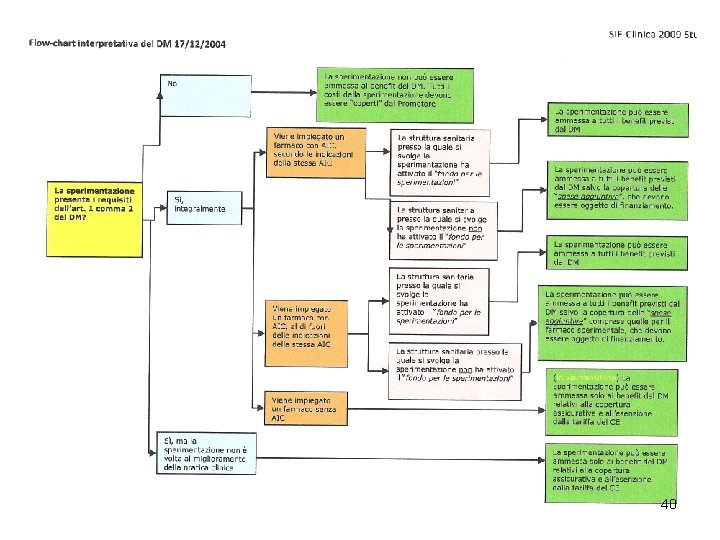
Successivamente il Ministero ha emanato una normativa specifica per le sperimentazioni no profit DECRETO 17 dicembre 2004 Prescrizioni e condizioni di carattere generale, relative all'esecuzione delle sperimentazioni cliniche dei medicinali, con particolare riferimento a quelle ai fini del miglioramento della pratica clinica, quale parte integrante dell'assistenza sanitaria. (G. U. Serie Generale n. 43 del 22 febbraio 2005) 37

D. M. 17 -12 -2004 Tipologia di sperimentazione. 1. Sperimentazioni finalizzate non a interesse privato o a fini di lucro, non a fini di lucro ma per interesse pubblico. 2. Sperimentazioni connotabili come rilevanti per il miglioramento della pratica clinica e, come tali, parte integrante dell'assistenza della pratica clinica sanitaria. 3. Sperimentazioni finalizzate non al medicinale in quanto tale o al suo finalizzate non al medicinale sviluppo ma alle strategie terapeutiche. es. definire il miglior ma alle strategie terapeutiche regime terapeutico (rischio/beneficio) di farmaci approvati; miglioramento dell'uso terapeutico dei farmaci (es. stabilendo migliori protocolli individuando associazioni o usi sequenziali di farmaci o di farmaci piu' altri interventi -chirurgia, radioterapia - piu' efficaci ecc. ). 4. Sperimentazioni rilevanti per la salute pubblica con obiettivi: rilevanti per la salute pubblica di evidente beneficio per i pazienti e/o per il rapporto costo/efficacia del sistema sanitario; in grado di offrire opportunita' aggiuntive alle prospettive terapeutiche e di salute ai pazienti; in grado di ottimizzare la qualita' delle prestazioni assistenziali. 5. Sperimentazioni in cui l'obiettivo di reale miglioramento della pratica clinica sia garantito da: la rilevanza del protocollo; la 38 particolarita' della patologia; la tipologia del trattamento. della patologia

D. M. 17 -12 -2004 Requisiti della sperimentazione a) il promotore della sperimentazione sia una istituzione pubblica promotore ad essa equiparata nel caso di associazioni o gruppi e' ad essa equiparata chiaramente esplicitato nello statuto della struttura stessa la natura non a fini di lucro b) la proprieta' dei dati relativi alla sperimentazione, alla sua dei dati esecuzione, ai suoi risultati appartengano alla struttura di cui alla appartengano alla struttura lettera a) che funge da promotore c) I risultati della sperimentazione siano pubblicati per decisione I risultati autonoma del promotore di cui alla lettera a) autonoma del promotore d) il promotore della sperimentazione non sia il proprietario del promotore brevetto del farmaco in sperimentazione o il titolare della brevetto del farmaco autorizzazione all'immissione in commercio e) la sperimentazione non sia finalizzata allo sviluppo industriale del farmaco o del farmaco comunque a fini di lucro 39

40

Attenzione preoccupante ingerenza delle Case farmaceutiche e delle CRO, conseguente: ►inferenza nella conduzione degli studi ►possibile “conflitto di interesse” tra sperimentatore ed industria ►possibile espediente per sottrarsi agli “oneri economici” connessi alla valutazione dei protocolli da parte dei CE (“tariffa per il rilascio del parere unico ovvero accettazione/rifiuto del parere unico”) ►tentativo per evitare le responsabilità gravanti sui Promotori secondo quanto stabilito dal D. L. 24 -06 -2003 41

STUDI SPERIMENTALI profit - no profit Sperimentazioni Cliniche Controllate (RCT): (studi di efficacia ) 42

. STUDI ANALITICI ( Osservazionali) trasversali (studi di Prevalenza) longitudinali ( studi di Prevalenza ed Incidenza) – Studi di Coorte – Studi Caso-Controllo 43

Particolare importanza negli studi osservazionali è l’aspetto etico dello studio che deve essere “prioritario” rispetto ad altre scelte 44

ETICITA’ ETICITA a) ETICA DELLE ASPETTATIVE: una sperimentazione è etica se esiste il dubbio fondato che il nuovo trattamento possa essere più efficace di quello normalmente utilizzato b) ETICA DEI RISULTATI : i risultati sono etici se ricercati ed ottenuti per problemi clinicamente rilevanti c) ETICA DEGLI SPERIMENTATORI : “ … la falsificazione dei dati, l’ analisi scorretta, la presentazione non obbiettiva dei risultati, il ritardo nella comunicazione dei risultati sfavorevoli influiscono sulla eticità della ricerca …” ( Marchioli e Tognoni, 1994) 45

RILEVANZA CLINICA Importanza della differenza rilevata negli esiti fra il gruppo dei trattati ed i controlli tale da indurre una modifica nella pratica clinica a) non tutte le differenze di esito statisticamente significative possono essere clinicamente rilevanti a) la rilevanza clinica può essere tale che in assenza di significatività statistica delle differenze di esito si possa ripetere la ricerca con un altro metodo (aumento del campione) 46

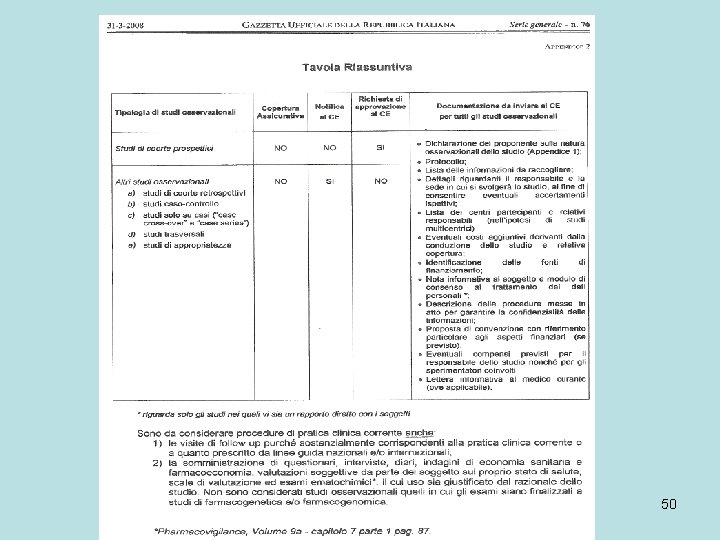
DETERMINAZIONE AIFA - 20 marzo 2008 Linee guida per la classificazione e conduzione degli studi osservazionali sui farmaci. (GU n. 76 del 31 -3 -2008 ) Art. 1. Sono approvate le linee guida sugli studi osservazionali… linee guida Art. 2. E' istituito il registro nazionale degli studi osservazionali… registro nazionale 47

Premessa DETERMINAZIONE AIFA - 20 marzo 2008 48

DETERMINAZIONE AIFA - 20 marzo 2008 49

50

PROCEDURA GENERALE PER L’ AVVIO STUDI OSSERVAZIONALI: - di coorte prospettici - altre tipologie di studi (diversi dagli studi di coorte prospettici) i Comitati Etici hanno il diritto di valutare tutti gli aspetti degli studi Comitati Etici hanno il diritto di valutare notificati in accordo alle procedure interne del Comitato Etico, segnalando, ove rilevato, incongruità rispetto a quanto dichiarato dal promotore; -il Comitato Etico, come da Linea Guida AIFA, ha il diritto di entrare nel merito delle valutazioni degli studi notificati; questo non implica alcun obbligo per il proponente di corrispondere il pagamento della tariffa, a obbligo per il proponente di corrispondere il pagamento della tariffa meno di specifiche normative o linee guida Regionali/delle Province Autonome; -laddove siano previste tariffe anche per le suddette attività, è auspicabile che queste siano rese pubbliche attraverso il sito internet dell’Osservatorio (Registro dei Comitati Etici/Bacheca); - in tutti i casi, trascorsi 60 giorni dalla notifica di una domanda nella trascorsi 60 giorni dalla notifica forma prescritta dalla Linea Guida AIFA, lo studio può essere avviato dal lo studio può essere avviato promotore avvalendosi della procedura del silenzio/assenso 51

Linee guida per i trattamenti di dati personali nell'ambito delle sperimentazioni cliniche di medicinali - 24 luglio 2008 G. U. n. 190 del 14 agosto 2008 PRIVACY : PERIODO DI CONSERVAZIONE E TRATTAMENTO DI DATI PER ULTERIORI FINI DI ICERCA I dati e i campioni biologici dei pazienti partecipanti alle sperimentazioni I dati e i campioni biologici devono essere conservati per un arco di tempo non superiore a quello necessario per conseguire le finalità per le quali sono stati raccolti e necessario trattati Al riguardo, la normativa applicabile alle sperimentazioni cliniche prevede che i documenti essenziali relativi allo studio (compresa la documentazione medica riferita ai singoli pazienti) debbano essere conservati presso lo sponsor e i centri partecipanti per almeno sette anni dopo il completamento della sperimentazione, ovvero per un periodo di tempo considerevolmente più lungo in conformità alla disciplina applicabile o agli accordi intervenuti tra sponsor e centri partecipanti Le società che hanno commissionato uno studio clinico possono utilizzare lecitamente in future attività di studio e di ricerca i dati e i campioni biologici riconducibili ai singoli interessati, anche avvalendosi riconducibili ai singoli interessati dei soggetti esterni che hanno collaborato con le prime per l'esecuzione della sperimentazione, a condizione che i pazienti ne siano stati previamente e adeguatamente informati e abbiano manifestato per iscritto un consenso specifico e distinto 52

Linee guida per i trattamenti di dati personali nell'ambito delle sperimentazioni cliniche di medicinali - 24 luglio 2008 G. U. n. 190 del 14 agosto 2008 PRIVACY: LE REGOLE PER L'USO DEI DATI GENETICI A FINI DI CURA E RICERCA Consenso informato della persona, rigorose misure di sicurezza, divieto di diffusione e conservazione a tempo Il Garante per la protezione dei dati personali ha così definito le regole per la raccolta e l'uso dei dati genetici a fini di ricerca e tutela della salute. Devono essere predisposte misure specifiche per accertare in modo univoco l'identità del soggetto a cui viene prelevato il materiale genetico, i dati identificativi devono essere tenuti separati già al momento della raccolta. È necessario informare l'interessato sugli scopi perseguiti, sui risultati conseguibili, sul periodo di conservazione dei dati e dei campioni biologici. Per trattare i dati genetici e utilizzare i campioni biologici è obbligatorio il consenso scritto dell'interessato, revocabile in ogni momento. 53

Linee guida per i trattamenti di dati personali nell'ambito delle sperimentazioni cliniche di medicinali - 24 luglio 2008 G. U. n. 190 del 14 agosto 2008 PRIVACY : TRATTAMENTO IN ASSENZA DI CONSENSO In presenza di particolari e comprovate circostanze (di carattere etico, particolari e comprovate circostanze metodologico o di impossibilità organizzativa), dalle quali derivi l'impossibilità di informare gli interessati, il trattamento può essere effettuato, anche in assenza del loro consenso, a condizione che il effettuato, anche in assenza del loro consenso programma di ricerca sia stato oggetto di motivato parere favorevole del competente comitato etico e venga ottenuta l'autorizzazione del competente comitato etico Garante, che può essere rilasciata anche con provvedimenti di carattere generale, relativi a determinate categorie di titolari o di trattamenti (artt. 110 ult. parte e 40 del Codice). Si pensi, ad esempio, ad alcuni studi di tipo retrospettivo in cui il tempo trascorso dal momento in cui i dati da analizzare sono stati raccolti, l'entità del campione da selezionare e le caratteristiche sulla base delle quali viene effettuato il campionamento (ad esempio, un gruppo di persone affette da patologie ad alta incidenza di mortalità) possono rendere ragionevolmente impossibile raggiungere gli interessati e fornire loro un'adeguata informativa. 54

Il futuro ? 55

DDL SPERIMENTAZIONE CLINICA approvato il 24 -09 -10 Delegato al Governo il riassetto e la riforma della normativa in materia di sperimentazione clinica …entro nove mesi. I Decreti dovranno prevedere il riordino e l'individuazione del numero dei Comitati etici con predisposizione di criteri di certificazione, prevedendo in ogni caso almeno un Comitato etico per ogni Regione e tenendo in considerazione il numero di Istituti di ricovero e cura a carattere scientifico presenti; l'individuazione dei requisiti dei centri autorizzati alla conduzione delle sperimentazioni cliniche dalla fase 0 alla fase IV; la realizzazione di una rete dei Comitati etici; meccanismi di valutazione delle performance delle aziende sanitarie pubbliche nell'ambito delle sperimentazioni cliniche; l'istituzione di un portale di consultazione per il cittadino. Le aziende che producono o commercializzano in Italia dispositivi medici, compresi i dispositivi medico-diagnostici, sono tenute, in occasione di ogni vendita effettuata a strutture del Servizio sanitario nazionale, al versamento a favore dell'acquirente di un contributo pari all'1 per cento della somma fatturata al netto dell'Iva. 56

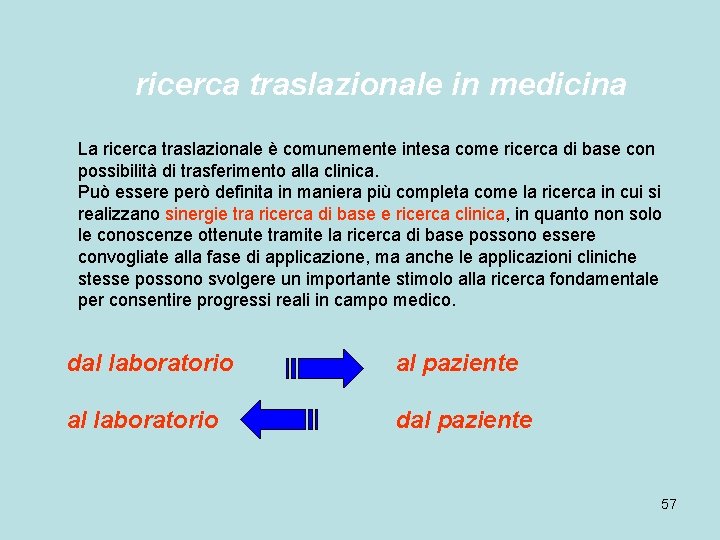
ricerca traslazionale in medicina La ricerca traslazionale è comunemente intesa come ricerca di base con possibilità di trasferimento alla clinica. Può essere però definita in maniera più completa come la ricerca in cui si realizzano sinergie tra ricerca di base e ricerca clinica, in quanto non solo le conoscenze ottenute tramite la ricerca di base possono essere convogliate alla fase di applicazione, ma anche le applicazioni cliniche stesse possono svolgere un importante stimolo alla ricerca fondamentale per consentire progressi reali in campo medico. dal laboratorio al paziente al laboratorio dal paziente 57

Grazie per l’attenzione 58

59

60

61

62

Fasi della sperimentazione Completata la fase preclinica il farmaco inizia la sperimentazione clinica che si divide in 4 fasi: 1. La sperimentazione di fase 1 è indirizzata a valutare la sicurezza del farmaco più che la sua efficacia. La ricerca può essere attuata su volontari sani per ottenere informazioni sulla biodisponibilità del farmaco in funzione delle diverse vie di somministrazione previste. Sul paziente volontario viene studiata la biodisponibilità di particolari principi attivi (per esempio gli antiblastici) e come viene modificata la biodisponibilità nell’insufficienza renale o epatica. Sempre sul paziente volontario si valuta il dosaggio ottimale del farmaco somministrando dosi crescenti, utilizzando come criterio di valutazione la comparsa di effetti collaterali. Si tratta in genere di pazienti già trattati in precedenza e per questo tipo di sperimentazione è ancora valida la raccomandazione fatta oltre 30 anni fa da Burdette e Gehan: “Non esistono protocolli da applicare rigidamente nella fase 1. Esistono dei presupposti per i protocolli, ma le conoscenze e l’intuito dello sperimentatore sono molto più importanti di uno specifico disegno sperimentale”. Questo principio non contrasta con il rigore dei criteri con cui alla fine si giudica la validità del dosaggio ottimale ottenuto. 2. La sperimentazione di fase 2 si attua su piccoli campioni di pazienti utilizzando dosaggi di farmaco prestabiliti per verificare controlli scrupolosi il possibile spettro di effetti farmacologici e utilizzando come criterio di valutazione un’eventuale risposta terapeutica. 3. La sperimentazione di fase 3 costituisce il fulcro della ricerca clinica dove l’efficacia del nuovo trattamento viene messa a confronto rispetto al placebo o alla terapia standard. In questa fase sono utilizzati preferenzialmente protocolli di ricerca clinica controllati e randomizzati. I criteri di valutazione (end-points) più solidi sono: il prolungamento della vita dei pazienti trattati, il rallentamento dell’evoluzione di un processo degenerativo, la riduzione della comparsa di complicanze d’organo, ecc. 4. La sperimentazione di fase 4 ricerca su un farmaco già in commercio per studiare l’impatto della sua efficacia o di effetti dannosi in un usuale contesto di prescrizione. Non deve essere confusa con lo studio su un possibile effetto in precedenza non evidenziato di un farmaco già commercializzato 63

FUNZIONI DEL COMITATO ETICO obbligatorie • Funzione valutativa (conformità dello studio a quanto previsto agli artt. 1 e 6 e allegati del DM 17 dicembre 2004); • Funzione di monitoraggio dell’andamento dello studio (ai sensi del 211/03); facoltative • Funzione formativa (ex DM 12 maggio 2006); • Funzione tecnico-amministrativa di supporto organizzativo (ex DM 21 dicembre 2007): referente per l’Os. SC 64

65

66
 Litigare con metodo. gestire i litigi dei bambini a scuola
Litigare con metodo. gestire i litigi dei bambini a scuola I quasi incidenti sono facili da individuare
I quasi incidenti sono facili da individuare Strutture testo argomentativo
Strutture testo argomentativo Sperimentazione clinica dispositivi medici
Sperimentazione clinica dispositivi medici Da quale parola latina deriva diario
Da quale parola latina deriva diario Regali aggettivo
Regali aggettivo Quale fu il rapporto tra i tiranni è il demos
Quale fu il rapporto tra i tiranni è il demos Tempo cronologico
Tempo cronologico Pronomi interrogativi e esclamativi
Pronomi interrogativi e esclamativi In quale contesto si sviluppa lo stilnovo
In quale contesto si sviluppa lo stilnovo Tutti i poligoni
Tutti i poligoni Promessi sposi genere
Promessi sposi genere Solo pensoso i più deserti campi
Solo pensoso i più deserti campi Quale personaggio è il centro della bibbia
Quale personaggio è il centro della bibbia Complemento di moto per luogo
Complemento di moto per luogo Quale scienza studia gli ecosistemi
Quale scienza studia gli ecosistemi Forma di governo irlanda
Forma di governo irlanda In quale periodo storico è ambientato l'orlando furioso
In quale periodo storico è ambientato l'orlando furioso Quale continente è tagliato a metà dall'equatore
Quale continente è tagliato a metà dall'equatore Corrente di verga
Corrente di verga











































